题目内容
【题目】某种手机电路板中含有Cu、Fe、Au、Ag、Ni(镍,银白色金属)等金属,如下是某工厂回收部分金属的流程图。已知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O
2CuSO4+2H2O
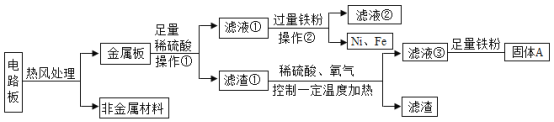
(1)操作①的名称是_____。
(2)写出滤液②中金属阳离子符号_____。
(3)写出滤液③和铁粉反应得到固体A的化学方程式___。
(4)Cu、Fe、Ni在溶液中的活动性由强到弱的顺序依次是___。
【答案】过滤 Fe2+ Fe+CuSO4=FeSO4+Cu Fe、Ni、Cu
【解析】
(1)操作①是将固体和液体分离,所以操作①的名称是过滤。
(2)滤液①为硫酸镍和硫酸的混合物,所以加入过量的铁得到的滤液②中金属阳离子只有亚铁离子,对应的符号是Fe2+。
(3)滤液③是硫酸铜、剩余的硫酸与铁粉反应,得到固体的反应是:Fe+CuSO4=FeSO4+Cu。
(4)由题意可知,由于加入足量的硫酸,镍和铁反应,说明镍和铁比铜活泼。而铁在滤液①中置换出镍单质,说明铁比镍活泼,所以Cu、Fe、Ni在溶液中的活动性由强到弱的顺序依次是:Fe>Ni>Cu。

练习册系列答案
相关题目