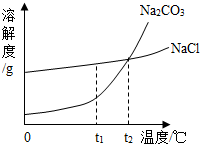
题目内容
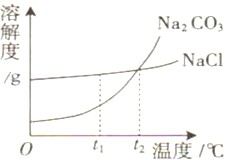 19、我国北方有许多盐湖,湖水中溶有大量的Na2CO3和NaCl,那里的人们冬天捞碱(Na2CO3),夏天晒盐(NaCl).Na2CO3和NaCl的溶解度曲线如下图所示,据图回答下列问题:
19、我国北方有许多盐湖,湖水中溶有大量的Na2CO3和NaCl,那里的人们冬天捞碱(Na2CO3),夏天晒盐(NaCl).Na2CO3和NaCl的溶解度曲线如下图所示,据图回答下列问题:(1)t1℃时,溶解度较大的物质是
NaCl
.(2)等质量Na2CO3、NaCl饱和溶液分别从t2℃降温到t1℃,析出晶体较多的是
Na2CO3
.(3)冬天捞碱的原因是由于Na2CO3的溶解度随温度降低而
减小
(填“增大”、“减小”或“不变”).(4)夏天晒盐是利用
②
(填序号)的方法,使NaCl晶体析出.①升高温度,使NaCl溶解度增大 ②风吹日晒.使溶剂蒸发.
分析:根据固体物质的溶解度曲线可以:①比较不同的物质在同一温度下的溶解度的大小,②判断物质的溶解度随温度变化的变化情况,从而判断等质量的饱和溶液降温时析出的晶体的多少,或判断通过降温还是蒸发溶剂的方法使溶质从溶液中结晶析出等.
解答:解:(1)由两物质的溶解度曲线不难看出,在t1℃时,氯化钠的溶解度大于碳酸钠的溶解度,故答案为:NaCl
(2)由于氯化钠和碳酸钠的溶解度都随温度的升高而增大,但碳酸钠的溶解度受温度的影响较大,因此把等质量Na2CO3、NaCl饱和溶液分别从t2℃降温到t1℃,析出晶体较多的是碳酸钠,故答案为:碳酸钠
(3)冬天捞碱说明温度降低时,该物质的溶解度减小,故答案为:减小
(4)由于氯化钠的溶解度受温度的影响很小,因此若想使氯化钠从溶液中结晶析出,主要采取蒸发溶剂的方法,故答案为:②
(2)由于氯化钠和碳酸钠的溶解度都随温度的升高而增大,但碳酸钠的溶解度受温度的影响较大,因此把等质量Na2CO3、NaCl饱和溶液分别从t2℃降温到t1℃,析出晶体较多的是碳酸钠,故答案为:碳酸钠
(3)冬天捞碱说明温度降低时,该物质的溶解度减小,故答案为:减小
(4)由于氯化钠的溶解度受温度的影响很小,因此若想使氯化钠从溶液中结晶析出,主要采取蒸发溶剂的方法,故答案为:②
点评:本题难度不是很大,主要考查了根据固体物质的溶解度曲线解决相关的问题,加强学生对固体溶解度的理解.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
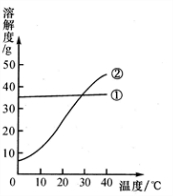 13、我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞碱(碳酸钠),夏天晒盐(氯化钠).
13、我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞碱(碳酸钠),夏天晒盐(氯化钠).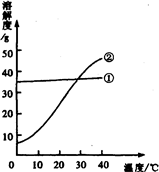 (2005?大连)我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞碱(碳酸钠),夏天晒盐(氯化钠).
(2005?大连)我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞碱(碳酸钠),夏天晒盐(氯化钠). (2006?云南)结晶是分离可溶性固体混合物的一种常用方法.我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞“碱”(碳酸钠),夏天晒盐(氯化钠).请你判断图中能反映碳酸钠溶解度变化的曲线是( )
(2006?云南)结晶是分离可溶性固体混合物的一种常用方法.我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞“碱”(碳酸钠),夏天晒盐(氯化钠).请你判断图中能反映碳酸钠溶解度变化的曲线是( )