题目内容
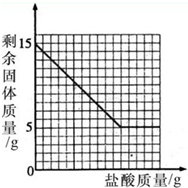 (2009?咸宁)为了测定石灰石中碳酸钙的含量,将粉碎后的15g石灰石样品(样品中杂质不溶于水,且不与酸反应)放入烧杯中,然后加入足量的盐酸完全反应.烧杯中剩余固体质量与加入盐酸质量的关系如图所示.请计算:
(2009?咸宁)为了测定石灰石中碳酸钙的含量,将粉碎后的15g石灰石样品(样品中杂质不溶于水,且不与酸反应)放入烧杯中,然后加入足量的盐酸完全反应.烧杯中剩余固体质量与加入盐酸质量的关系如图所示.请计算:(1)该石灰石样品中碳酸钙的质量分数(计算结果保留一位小数).
(2)如果盐酸的质量分数为7.3%,求恰好反应时盐酸的质量.
分析:根据图示可知固体质量的减少量就是参加反应的碳酸钙质量,根据碳酸钙的质量除以石灰石样品的质量乘以百分之百,根据碳酸钙质量算出氯化氢的质量,再除以7.3%即可.
解答:解:(1)根据图示,样品中碳酸钙的质量为15g-5g=10g
该石灰石样品中碳酸钙的质量分数
×100%=66.7%
(2)设恰好反应时,氯化氢的质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O (1分)
100 73
10g x
根据:
=
解得x=7.3g.
恰好反应时盐酸的质量=
=100g
答:该石灰石样品中碳酸钙的质量分数为66.7%;恰好反应时盐酸的质量为100g.
故答案为:(1)66.7%;(2)100g.
该石灰石样品中碳酸钙的质量分数
| 10g |
| 15g |
(2)设恰好反应时,氯化氢的质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O (1分)
100 73
10g x
根据:
| 100 |
| 73 |
| 10g |
| x |
恰好反应时盐酸的质量=
| 7.3g |
| 7.3% |
答:该石灰石样品中碳酸钙的质量分数为66.7%;恰好反应时盐酸的质量为100g.
故答案为:(1)66.7%;(2)100g.
点评:解答本题关键是要知道固体质量减少的原因是碳酸钙与盐酸反应了,所以固体质量减少了多少,参加反应的碳酸钙的质量就是多少,根据碳酸钙的质量再进一步进行计算即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 其中x=
其中x=