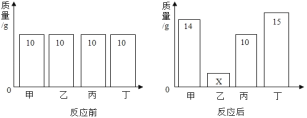
题目内容
下列有关空气及其成分的说法正确的是( )
A. 空气中体积分数最大的是氧气
B. 稀有气体有不同的颜色,可制成霓虹灯
C. 大气中二氧化碳含量不断上升,会导致酸雨的形成
D. 氧气比较活泼,在一定条件下能与许多物质发生化学反应
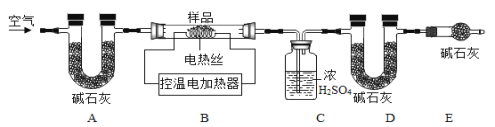
根据提供的实验装置回答问题。
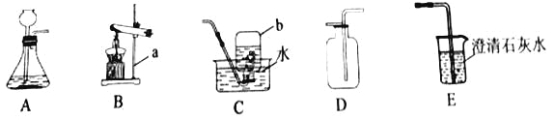
(1)写出实仪器名称:a为_______;b为__________。
(2)实验室用B装置制取O2,发生反应的化学方程式为__________。
(3)实验室制取CO2的发生和收集装置是________(填字母序号),CO2通过E装置可观察到的实验现象是____________。小明在实验中用C装置收集到一瓶CO2,为了弄清其中道理,他可采取的科学态度和方法是_______(填数字序号)。
①置之不理 ②查阅资料 ③交流讨论 ④请教老师
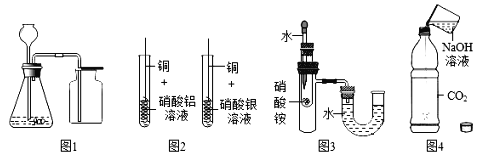
(4)CO2能与NaOH发生反应
【实验过程】检查装置气密性。如图所示连接好装置。进行实验。
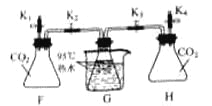
序号 | 操作步骤 | 实验现象 |
I | 打开弹簧夹K1,关闭弹簧夹K2、K3、K4,将20mL水注入锥形瓶F中,关闭弹簧夹K1,振荡瓶F,打开弹簧夹K2 | 无明显现象 |
II | 关闭弹簧夹K2,打开弹簧夹K4,将20mLNaOH溶液注入锥形瓶H中,关闭弹簧夹K4,振荡瓶H,打开弹簧夹K3 | 锥形瓶G中的热水剧烈沸腾 |
【实验分析】锥形瓶G中热水剧烈沸腾的原因是_____________。
【实验反思】有观点认为只需要进行实验操作Ⅱ,即可说明CO2与NaOH发生反应。你对该观点的看法是________(选填“赞同”或“不赞同”),理由是____________。
某学习小组的同学对过氧化氢分解进行探究。
Ⅰ.(探究一)影响过氧化氢分解快慢的因素
某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素。(实验装置如图所示,夹持仪器已略去)

(猜想与假设)影响过氧化氢分解速率的因素可能有
温度、溶液的浓度、催化剂种类。
(实验记录)同学们进行6组实验,实验记录如下:
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
过氧化氢溶液的浓度(%) | 30 | 30 | 15 | 30 | 30 | 30 |
过氧化氢溶液的体积(mL) | 6 | x | 6 | 6 | 6 | 6 |
水槽中水的温度 | 20 | 90 | 70 | 70 | 20 | 20 |
锥形瓶中的物质 | ----- | ----- | ----- | ----- | 0.5 gNaCl | 0.5 gFeCl3 |
60 min内产生氧气(mL) | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
(解释与结论)
(1)实验②中应加入过氧化氢溶液的体积x是______mL。
(2)实验①~⑥通过测定相同时间内产生氧气的体积来比较过氧化氢的分解速率,还可以通过测定______来比较过氧化氢的分解速率。
(3)得出“过氧化氢溶液的浓度越大分解速率越大”结论所依据的实验是_____(填序号)。
(4)通过实验①、②、④可得出的结论是______。
(反思与评价)
(5)同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是______(答两点)。
(6)某同学改用如图所示装置代替气囊完成实验②,

正确的实验操作顺序是______。
a将导管伸入量筒,开启控温加热器,滴入过氧化氢溶液
b开启控温加热器,将导管伸入量筒,滴入过氧化氢溶液
c开启控温加热器,滴入过氧化氢溶液,待导管口有连续均匀气泡冒出时将导管伸入量筒
Ⅱ、(探究二)探究Fe2O3是否对过氧化氢分解起催化作用
操作步骤 | 实验情况记录 | 结论 | |
① |
| A试管上方带火星的木条未复燃 B中出现气泡快,带火星的木条复燃 | Fe2O3_____(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
② | 将B试管中的混合物过滤,把滤渣烘干、_____。 | 固体质量0.2g | Fe2O3质量未变 |
小组的同学认为要证明Fe2O3是催化剂,上述实验还不够,还需要再增加一个实验,
a、该实验的目的是:_____
b、请你设计实验证明,简要的写出实验步骤及实验现象:_____。
归纳与整理利于梳理知识,小明同学整理的下列各组化学知识全部正确的是( )
A.灭火的原理与方法 | B.反应类型 | C.物质俗名 | D.化学与生活 |
烧杯罩灭蜡烛﹣﹣隔绝氧气; 森林起火设置隔离带﹣﹣清除可燃物; 高压水枪灭火﹣﹣降低着火点 | 碳燃烧﹣﹣化合反应; 小苏打治疗胃酸过多 ﹣﹣中和反应; 双氧水制取氧气﹣﹣分解反应 | 固态二氧化碳﹣﹣干冰; 氧化钙﹣﹣熟石灰; 碳酸氢钠﹣﹣苏打 | 软化硬水﹣﹣煮沸; 除水垢﹣﹣用食醋浸泡; 改良酸性土壤﹣﹣ 施用Ca(OH)2 |
A. A B. B C. C D. D