题目内容
【题目】有一包固体粉末,可能含有氧化钙、氯化钠、碳酸钠、硫酸钠中的一种或几种。为确定其组成,小杨设计出实验方案,实验步骤及现象如下。请回答:
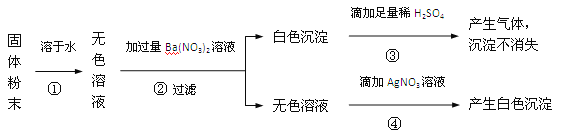
(1)写出步骤④中产生白色沉淀的化学方程式______。
(2)根据实验中的现象,能否确定原固体粉末的组成?若能,请写出各成分的化学式;若不能,在原实验步骤的基础上,对上述方案中的试剂作一改进,并描述相应的实验现象及结论,以确定固体粉末的组成。____________。
【答案】(1)NaCl+AgNO3=AgCl↓+NaNO3 或BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2
(2)将步骤③中“稀H2SO4”改成“稀HCl(或稀HNO3)”;
如果产生气体,沉淀完全溶解,说明固体粉末中含Na2CO3(或Na2CO3和NaCl);如果产生气体,沉淀不完全溶解,说明固体粉末中含Na2CO3、Na2SO4(或Na2CO3、Na2SO4和NaCl)。
【解析】
试题分析:氧化钙会与水反应生成氢氧化钙,氢氧化钙不能与碳酸钠共存。溶解得到的无色溶液与硝酸钡反应得到了白色沉淀,那么白色沉淀可能是硫酸钡沉淀或碳酸钡沉淀,由于碳酸钡会与硫酸反应生成硫酸钡沉淀、水和二氧化碳,故加入硫酸白色沉淀不消失不能判断出是否含有碳酸钡沉淀,若把硫酸该为稀硝酸即可根据沉淀是否消失判断是否含有碳酸钡沉淀。
(1)根据加入硝酸银溶液生成白色沉淀,那么溶液中一定含有氯离子,那么固体中一定含有氯化钠:NaCl+AgNO3=AgCl↓+NaNO3 ;
(2)由于碳酸钡会与硫酸反应生成硫酸钡沉淀、水和二氧化碳,故加入硫酸白色沉淀不消失不能判断出是否含有碳酸钡沉淀,若把硫酸该为稀硝酸即可根据沉淀是否消失判断是否含有碳酸钡沉淀从而判断碳酸钠的存在。

练习册系列答案
相关题目