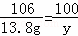题目内容
某K2C03样品中含有Na2C03、KN03和Ba(N03)2三种杂质中的一种或二种.现将13.8克样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9克沉淀.对样品所含杂质的正确判断是( )
|
| A. | 肯定有Na2C03 | B. | 肯定有KN03,可能还含有Na2C03 |
|
| C. | 肯定没有Ba(N03)2,可能有KN03 | D. | 肯定没有Na2C03和Ba(NO3)2 |
分析:
| 取样品加入水中,全部溶解,则不可能硝酸钡,加入氯化钙能产生沉淀,然后根据沉淀的质量进一步确定碳酸钠和硝酸钾的存在. | |
| 解答: | 解:样品加入水中,全部溶解,说明一定无硝酸钡,假设13.8g纯碳酸钾产生碳酸钙的质量为x,则有 K2C03+CaCl2═CaCO3↓+2KCl 138 100 13.8g x
x=10g 假设13.8g纯碳酸钠产生碳酸钙的质量为y,则有 Na2C03+CaCl2═CaCO3↓+2NaCl 106 100 13.8g y
y≈13g 含有一种杂质是:只能是含有硝酸钾,而不能含有碳酸钠.若含有碳酸钠则得到沉淀的质量应该大于10g小于13g,而实际只得到9g,故不可能含有碳酸钠,一定含有硝酸钾. 含有两种杂质是:是硝酸钾和碳酸钠的混合物. 故选B. |

练习册系列答案
相关题目
某K2C03样品中含有Na2C03、KN03和Ba(N03)2三种杂质中的一种或二种.现将13.8克样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9克沉淀.对样品所含杂质的正确判断是( )
| A、肯定有Na2C03 | B、肯定有KN03,可能还含有Na2C03 | C、肯定没有Ba(N03)2,可能有KN03 | D、肯定没有Na2C03和Ba(NO3)2 |