题目内容
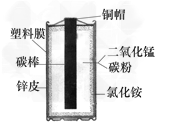
【题目】实验室可选用下列装置进行多种气体的制取和性质验证的实验.

回答下列问题:
(1)写出带有标号仪器的名称:① ;② .
(2)利用A装置制取O2,写出发生反应的化学方程式 ,收集装置应选用 .
(3)制取H2应选用 装置,收集装置应选用 .
(4)某同学选用C装置制得的CO2,并将制得的CO2通过澄清的石灰水中,未见浑浊.分析原因可能有下列两种情况:
a.可能是错用了较浓的盐酸,使制得的CO2中混入氯化氢气体,使生成的沉淀溶解,沉淀溶解的化学方程式为 ;
b.可能生成的CaCO3又与CO2反应生成了可溶性的Ca(HCO3)2,此反应类型为 ,为了判断是否是a种原因,应选用上述 装置(填装置编号).为了判断是否是b种原因,他将未见浑浊的溶液加热,出现了沉淀,同时产生了气泡,写出产生此现象的化学反应化学方程式 .
【答案】(1)铁架台;集气瓶(2)2KMnO4===K2MnO4+MnO2+O2↑或(![]() )E
)E
(3)C、D (4)CaCO3+2HCl=CaCl2+H2O+CO2↑;化合;G;![]()
【解析】
试题分析:(1)由图可得仪器名称;(2)发生装置为固体加热型因此可以是高锰酸钾或者氯酸钾加热分解制取氧气;氧气不易溶于水,密度比空气大收集装置选E。
(3)实验室用活泼金属与酸反应,为固体与液体不需加热型,发生装置选C;氢气不溶于水,密度比空气小收集装置选D或者E; (4)即盐酸与沉淀碳酸钙反应的方程式;CaCO3+ H2O+ CO2=Ca(HCO3)2,三种生成一种为化合反应;二氧化碳与水反应生成碳酸显酸性,盐酸也显酸性都能使石蕊变红,因此选G只会与盐酸反应生成氯化银沉淀除去盐酸;溶于水的碳酸氢钙加热又分解为不溶于水的碳酸钙和水和二氧化碳。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定了反应后溶液的pH,得到了如下图所示的pH曲线,请回答:
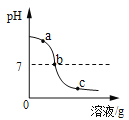
(1)由图可知该实验操作是将__________滴加到另一种溶液中;
(2)该反应的化学方程式为___________;
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl。
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现___________的现象。结论:该样品是a处溶液。
②为进一步确定b或c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液。 | ________ | 该样品为b处溶液。 |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑____________。