题目内容
某硫酸钠样品中含有少量氯化钠.取15g该样品于烧杯中,加入50g水后完全溶解.向烧杯中滴加208.3g氯化钡溶液,恰好完全反应,过滤、干燥,称得固体物质的质量为23.3g.请计算
已知:BaCl2+Na2SO4=BaSO4↓+2NaCl
(1)硫酸钠样品中氯化钠的质量
(2)若将滤液的溶质质量分数变为10%,需蒸发掉水的质量.
解:(1)设:样品中硫酸钠的质量为x,生成氯化钠的质量为y.
BaCl2+Na2SO4═BaSO4↓+2NaCl
142 233 117
x 23.3 g y
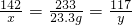
x=14.2 g y=11.7 g
样品中氯化钠的质量=15g-14.2g=0.8g
答:样品中氯化钠的质量为0.8g.
(2)设蒸发水的质量为m.
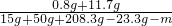 =10%
=10%
解得m=125g
答:若将滤液的溶质质量分数变为10%,需蒸发掉水的质量为125g.
分析:(1)根据硫酸钠与氯化钡恰好完全反应,由沉淀的质量以及反应方程式即可计算出参加反应的硫酸钠的质量,进而求算出氯化钠的质量.
(2)根据溶质的质量分数= .溶质的质量为反应生成的氯化钠和原来样品中的氯化钠质量之和.溶液的质量为样品的质量加上溶解它的水的质量加上氯化钡溶液的质量,然后减去生成的沉淀的质量和减去蒸发掉的水的质量.
.溶质的质量为反应生成的氯化钠和原来样品中的氯化钠质量之和.溶液的质量为样品的质量加上溶解它的水的质量加上氯化钡溶液的质量,然后减去生成的沉淀的质量和减去蒸发掉的水的质量.
点评:本题主要考查学生判断物质间的反应关系以及运用化学方程式进行计算的能力.学生需认真分析反应关系,正确书写化学方程式,才能解决
BaCl2+Na2SO4═BaSO4↓+2NaCl
142 233 117
x 23.3 g y
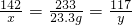
x=14.2 g y=11.7 g
样品中氯化钠的质量=15g-14.2g=0.8g
答:样品中氯化钠的质量为0.8g.
(2)设蒸发水的质量为m.
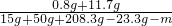 =10%
=10%解得m=125g
答:若将滤液的溶质质量分数变为10%,需蒸发掉水的质量为125g.
分析:(1)根据硫酸钠与氯化钡恰好完全反应,由沉淀的质量以及反应方程式即可计算出参加反应的硫酸钠的质量,进而求算出氯化钠的质量.
(2)根据溶质的质量分数=
 .溶质的质量为反应生成的氯化钠和原来样品中的氯化钠质量之和.溶液的质量为样品的质量加上溶解它的水的质量加上氯化钡溶液的质量,然后减去生成的沉淀的质量和减去蒸发掉的水的质量.
.溶质的质量为反应生成的氯化钠和原来样品中的氯化钠质量之和.溶液的质量为样品的质量加上溶解它的水的质量加上氯化钡溶液的质量,然后减去生成的沉淀的质量和减去蒸发掉的水的质量.点评:本题主要考查学生判断物质间的反应关系以及运用化学方程式进行计算的能力.学生需认真分析反应关系,正确书写化学方程式,才能解决

练习册系列答案
相关题目