题目内容
在下列铁的化合物中,含铁量最高的是
[相对原子质量:Fe-56,O-16,S-32].
- A.FeO
- B.Fe2O3
- C.Fe3O4
- D.FeS
A
分析:根据化合物中某元素的质量分数的计算方法进行计算,物质中某元素的质量分数═ ×100%×100%;或者对几种化合物中共同含有某一元素的含量进行比较可以用归一法,先把每个化学式变形成只含有一个铁原子的式子,与铁原子结合的氧原子个数越少,铁的质量分数越大,与铁原子结合的原子的相对原子质量越小,铁的质量分数越大.
×100%×100%;或者对几种化合物中共同含有某一元素的含量进行比较可以用归一法,先把每个化学式变形成只含有一个铁原子的式子,与铁原子结合的氧原子个数越少,铁的质量分数越大,与铁原子结合的原子的相对原子质量越小,铁的质量分数越大.
解答:先把每个化学式FeO,Fe2O3,Fe3O4,FeS变形成只含有一个铁原子的式子,分别为:FeO、Fe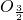 、Fe
、Fe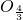 ,FeS,与铁原子结合的氧原子个数越少,铁的质量分数越大,由此可知:在铁的氧化物中FeO中铁原子结合的氧原子个数最少,因此铁元素的质量分数最高;与铁原子结合的原子的相对原子质量越小,铁的质量分数越大,氧的相对原子质量是16小于硫的相对原子质量32,由此可得出,FeO中铁元素的质量分数大于FeS中铁元素的质量分数.
,FeS,与铁原子结合的氧原子个数越少,铁的质量分数越大,由此可知:在铁的氧化物中FeO中铁原子结合的氧原子个数最少,因此铁元素的质量分数最高;与铁原子结合的原子的相对原子质量越小,铁的质量分数越大,氧的相对原子质量是16小于硫的相对原子质量32,由此可得出,FeO中铁元素的质量分数大于FeS中铁元素的质量分数.
故选A.
点评:本题主要考查了学生有关物质中某元素质量分数的计算,本题在掌握化合物中某元素质量分数的计算的基础上利用归一进行比较计算比较简单.
分析:根据化合物中某元素的质量分数的计算方法进行计算,物质中某元素的质量分数═
 ×100%×100%;或者对几种化合物中共同含有某一元素的含量进行比较可以用归一法,先把每个化学式变形成只含有一个铁原子的式子,与铁原子结合的氧原子个数越少,铁的质量分数越大,与铁原子结合的原子的相对原子质量越小,铁的质量分数越大.
×100%×100%;或者对几种化合物中共同含有某一元素的含量进行比较可以用归一法,先把每个化学式变形成只含有一个铁原子的式子,与铁原子结合的氧原子个数越少,铁的质量分数越大,与铁原子结合的原子的相对原子质量越小,铁的质量分数越大.解答:先把每个化学式FeO,Fe2O3,Fe3O4,FeS变形成只含有一个铁原子的式子,分别为:FeO、Fe
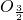 、Fe
、Fe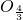 ,FeS,与铁原子结合的氧原子个数越少,铁的质量分数越大,由此可知:在铁的氧化物中FeO中铁原子结合的氧原子个数最少,因此铁元素的质量分数最高;与铁原子结合的原子的相对原子质量越小,铁的质量分数越大,氧的相对原子质量是16小于硫的相对原子质量32,由此可得出,FeO中铁元素的质量分数大于FeS中铁元素的质量分数.
,FeS,与铁原子结合的氧原子个数越少,铁的质量分数越大,由此可知:在铁的氧化物中FeO中铁原子结合的氧原子个数最少,因此铁元素的质量分数最高;与铁原子结合的原子的相对原子质量越小,铁的质量分数越大,氧的相对原子质量是16小于硫的相对原子质量32,由此可得出,FeO中铁元素的质量分数大于FeS中铁元素的质量分数.故选A.
点评:本题主要考查了学生有关物质中某元素质量分数的计算,本题在掌握化合物中某元素质量分数的计算的基础上利用归一进行比较计算比较简单.

练习册系列答案
相关题目