题目内容
【题目】用下图所示的装置进行如下实验: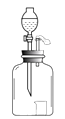
(1)若在分液漏斗中盛有浓氨水,小烧杯中盛有无色酚酞试液,将氨水放入集气瓶中,观察到的现象是。
(2)若小烧杯中盛有白磷,集气瓶内盛有固体氢氧化钠,将分液漏斗中适量水放入,观察到白磷燃烧,白磷燃烧的原因是。
(3)若分液漏斗中盛有5%的过氧化氢溶液,集气瓶内盛有二氧化锰,小烧杯内盛有白磷。将适量过氧化氢溶液放入集气瓶中,发生反应的化学方程式为 , (提示:已知该反应放热),则观察到的现象是。将本实验与上述实验(2)对比,你得出的结论是。
【答案】
(1)烧杯中的酚酞慢慢变红
(2)氢氧化钠溶于水放热使白磷达到着火点
(3)2H2O2![]()
![]() 2H2O + O2↑,有气泡冒出,白磷剧烈燃烧,产生大量白烟(气球变鼓),氧气浓度越大,燃烧越剧烈
2H2O + O2↑,有气泡冒出,白磷剧烈燃烧,产生大量白烟(气球变鼓),氧气浓度越大,燃烧越剧烈
【解析】(1)氨水呈碱性,能使无色的酚酞试液变成红色,由于分子在不断的运动,故现象是烧杯中的酚酞慢慢变红;(2)燃烧需要同时满足三个条件:一是要有可燃物,二是可燃物要与氧气接触,三是温度要达到可燃物的着火点;以上三个条件都能满足时,可燃物才能发生燃烧。现有白磷和氧气,那么是氢氧化钠溶于水放热使白磷达到着火点;(3)过氧化氢在二氧化锰的催化作用生成水和氧气:2H2O2 ![]()
![]() 2H2O + O2↑;该反应是放热反应,产生了氧气,温度到达了白磷的着火点,故白磷能燃烧,产生大量的白烟;该实验中氧气的浓度较大,白磷燃烧更剧烈,即氧气浓度越大,燃烧越剧烈。
2H2O + O2↑;该反应是放热反应,产生了氧气,温度到达了白磷的着火点,故白磷能燃烧,产生大量的白烟;该实验中氧气的浓度较大,白磷燃烧更剧烈,即氧气浓度越大,燃烧越剧烈。
故答案为:(1)烧杯中的酚酞慢慢变红;(2)氢氧化钠溶于水放热使白磷达到着火点;(3 )2H2O2 ![]()
![]() 2H2O + O2↑;有气泡冒出,白磷剧烈燃烧,产生大量白烟(气球变鼓);氧气浓度越大,燃烧越剧烈
2H2O + O2↑;有气泡冒出,白磷剧烈燃烧,产生大量白烟(气球变鼓);氧气浓度越大,燃烧越剧烈
(1)浓氨水易挥发,氨水能使酚酞试液变红;
(2)氢氧化钠溶于水放热,白磷的着火点是40摄氏度;
(3)过氧化氢在二氧化锰催化下生成水和氧气,白磷在空气中燃耗,放出热量,生成大量白烟

 阅读快车系列答案
阅读快车系列答案