题目内容
【题目】某金属冶炼厂在生产过程中产生了一定量的含铜废料。化学兴趣小组利用稀硫酸和铁粉分离回收铜,并获得硫酸亚铁晶体。其设计方案如图1所示。

查阅资料得知:在通入空气并加热的条件下,铜可与稀硫酸反应转化为硫酸铜,反应的化学方程式:2Cu+2H2SO4+O2![]() 2CuSO4+2H2O。
2CuSO4+2H2O。
(1)步骤Ⅰ中分离得到固体A和蓝色溶液B的操作名称是___。
(2)蓝色溶液B中的溶质是____(填化学式)。
(3)写出步骤Ⅲ中发生反应的化学方程式____。
(4)硫酸亚铁可用作治疗____(选填“贫血症”或“佝偻病”)的药物。
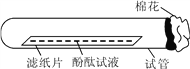
(5)铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu2(OH)2CO3]。根据铜锈的主要成分中含有氢元素和碳元素,可以判断出铜锈需要空气中的____(填化学式)。若要探究“铜生锈是否需要空气中的氧气?”如图2所示实验中,只需完成____(填字母)两个实验即可达到实验目的。
【答案】(1)过滤;(2)CuSO4、H2SO4;(3)Fe+H2SO4═FeSO4+H2↑;
(4)贫血症;(5)H2O、CO2,BD。
【解析】试题分析:由题意可知,废料中的铜与氧气反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜和水,所以蓝色溶液中的溶质中含有硫酸铜,根据蓝色溶液中加入铁有气体产生,说明蓝色溶液中含有过量的硫酸,所以溶质中还含有硫酸;加入铁粉是利用铁与硫酸铜反应生成铜和硫酸亚铁,将铜置换出来,得到硫酸亚铁,铁与硫酸反应生成硫酸亚铁和氢气,也是获得硫酸亚铁,所以加入略过量的铁粉,过量的目的是使CuSO4、H2SO4完全反应;固体C中可能含有铁所以先用硫酸清洗把铁除掉,再用水冲洗,最后进行干燥就能得到铜了.所以:(1)步骤Ⅰ中分离得到固体A和蓝色溶液B的操作名称是过滤;(2)由上述分析可知,蓝色溶液B中的溶质是 CuSO4、H2SO4;(3)由上述分析可知,步骤Ⅲ中发生反应的化学方程式是:Fe+H2SO4═FeSO4+H2↑;(4)硫酸亚铁可用作治疗贫血症的药物;(5)铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu2(OH)2CO3].根据铜锈的主要成分中含有氢元素和碳元素,可以判断出铜锈需要空气中的H2O、CO2.若要探究“铜生锈是否需要空气中的氧气?”如图2所示实验中,只需完成BD两个实验即可达到实验目的。