题目内容
如图所示,甲、乙两试管中分别盛有硝酸钾溶液和熟石灰的饱和溶液,并都有少量的固体存在.若向试管外烧杯的水中加入浓硫酸,甲中产生的现象是 ,其原因是 ;若向试管外烧杯的水中加入硝酸铵,乙中产生的现象是 ,其原因是 .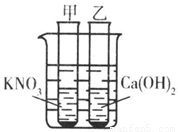
【答案】分析:硝酸钾的溶解度随温度的升高而升高;氢氧化钙随温度的升高而降低,然后根据浓硫酸和硝酸铵溶于水时溶液温度的变化情况进行分析.
解答:解:硝酸钾的溶解度随温度的升高而升高;氢氧化钙随温度的升高而降低,因为浓硫酸溶于水放热,故可知烧杯中加入浓硫酸后,两试管中固体量的变化是硝酸钾减少,氢氧化钙增多;硝酸铵溶于水吸热,故可知烧杯中加入硝酸铵后,两试管中固体量的变化是硝酸钾增多,氢氧化钙减少;
故答案为:硝酸钾减少,氢氧化钙增多;浓硫酸溶于水时放出大量的热;硝酸钾增多,氢氧化钙减少;硝酸铵溶于水吸热.
点评:实验现象与溶解度曲线的结合,体现出知识的综合运用,考查了分析问题的能力,主要是利用了物质的溶解度随温度变化的趋势.
解答:解:硝酸钾的溶解度随温度的升高而升高;氢氧化钙随温度的升高而降低,因为浓硫酸溶于水放热,故可知烧杯中加入浓硫酸后,两试管中固体量的变化是硝酸钾减少,氢氧化钙增多;硝酸铵溶于水吸热,故可知烧杯中加入硝酸铵后,两试管中固体量的变化是硝酸钾增多,氢氧化钙减少;
故答案为:硝酸钾减少,氢氧化钙增多;浓硫酸溶于水时放出大量的热;硝酸钾增多,氢氧化钙减少;硝酸铵溶于水吸热.
点评:实验现象与溶解度曲线的结合,体现出知识的综合运用,考查了分析问题的能力,主要是利用了物质的溶解度随温度变化的趋势.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
 如图所示的甲、乙两装置都可以用来进行木炭还原氧化铜的实验,小刚同学选用甲装置来进行实验:
如图所示的甲、乙两装置都可以用来进行木炭还原氧化铜的实验,小刚同学选用甲装置来进行实验:(1)在实验过程中,W形管的左边能观察到的现象是
(2)小刚观察到W形管右边的澄清石灰水变浑浊,反应的化学方程式是
(3)实验过程中,小刚发现W管右端的气球鼓起来了,实验结束冷却到室温后,气球依然鼓着,他经过探究发现气球中的气体是二氧化碳和一氧化碳的混合物.小刚查阅资料得知:木炭和氧化铜高温时也可以反应产生铜和一氧化碳,这个反应的化学方程式为
(4)甲乙两种装置相比,甲装置的优点之一是
(5)小刚进行木炭还原氧化铜的实验(该条件下氧化铜被完全还原为金属铜),实验完成后得到了8g金属铜.试计算实验中参加反应的氧化铜的质量.(请写出简单计算过程)
(6)小刚继续用生成的铜来探究铜与稀硫酸在加热的条件下能否发生反应的实验时,发现加热沸腾一段时间后,溶液开始变成淡蓝色,同时产生较多的气泡.生成的是什么气体呢?
[提出猜想]①可能是H2;②可能是O2;③可能是SO2
任何的猜想都要有依据,则小刚提出猜想的依据是:
[查阅资料]①铜与热的浓硫酸反应产生SO2;②SO2与Ca(OH)2反应生成难溶的CaSO3.
[实验验证]请你根据以下实验条件,设计实验验证小刚的猜想,并将相关内容填在下表.
仅限选择的用品和试剂:试管;木条、澄清石灰水.
| 实验步骤 | 实验操作 | 预期现象和结论 |
| 第一步 | ||
| 第二步 |
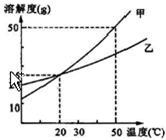 如图所示为甲、乙两物质(均不含结晶水)的溶解度曲线,请你根据曲线回答以下问题:
如图所示为甲、乙两物质(均不含结晶水)的溶解度曲线,请你根据曲线回答以下问题: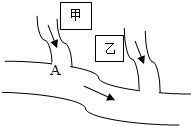 (2005?烟台)如图所示,甲、乙两个相邻的工厂向河水中排放的废水中分别含有CuSO4、NaOH、BaCl2、FeCl3四种物质中的两种.某中学环保小组对河水取样测试时发现A处河水的pH>7.试回答:
(2005?烟台)如图所示,甲、乙两个相邻的工厂向河水中排放的废水中分别含有CuSO4、NaOH、BaCl2、FeCl3四种物质中的两种.某中学环保小组对河水取样测试时发现A处河水的pH>7.试回答: