题目内容
课外活动小组的同学对学校附近的赤铁矿中Fe2O3含量进行测定.取样品20g加到309g盐酸中,恰好完全反应后,经过滤、干燥、称重,得滤渣的质量为4g(杂质不与盐酸反应).请计算:(相对原子质量:Fe-56、O-16、Cl-35.5)(1)赤铁矿中Fe2O3的质量分数.
(2)反应后所得滤液中溶质的质量分数.
【答案】分析:(1)恰好完全反应后,滤渣的质量就是赤铁矿样品中杂质的质量,故样品质量-样品中杂质的质量=赤铁矿中Fe2O3的质量;然后根据质量分数公式即可计算出赤铁矿中Fe2O3的质量分数;
(2)利用Fe2O3与盐酸反应的化学方程式和Fe2O3的质量,列出比例式,即可计算出滤液中FeCl3的质量,然后根据溶质质量分数=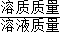 ×100%计算即可.
×100%计算即可.
解答:解:(1)赤铁矿中Fe2O3的质量为:20g-4g=16g,
赤铁矿中Fe2O3的质量分数: ;
;
(2)设滤液中FeCl3的质量为x,
Fe2O3+6HCl=2FeCl3+3H2O(1分)
160 2×162.5
16g x
 ,
,
解之得: ,
,
滤液中溶质的质量分数为: .
.
答:(1)赤铁矿中Fe2O3的质量分数为80%;
(2)滤液中溶质的质量分数为10%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
(2)利用Fe2O3与盐酸反应的化学方程式和Fe2O3的质量,列出比例式,即可计算出滤液中FeCl3的质量,然后根据溶质质量分数=
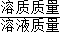 ×100%计算即可.
×100%计算即可.解答:解:(1)赤铁矿中Fe2O3的质量为:20g-4g=16g,
赤铁矿中Fe2O3的质量分数:
 ;
;(2)设滤液中FeCl3的质量为x,
Fe2O3+6HCl=2FeCl3+3H2O(1分)
160 2×162.5
16g x
 ,
,解之得:
 ,
,滤液中溶质的质量分数为:
 .
.答:(1)赤铁矿中Fe2O3的质量分数为80%;
(2)滤液中溶质的质量分数为10%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
某课外活动小组的同学对一批钢铁样品(含杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行了实验,其中只有一位同学所取的稀硫酸与样品恰好完全反应,实验数据如下:
请你根据所给数据,回答下列问题:
(1)所取的稀硫酸与钢铁样品恰好完全反应的是 同学.
(2)该钢铁样品中含铁的质量分数为多少?
| 甲 | 乙 | 丙 | |
| 烧杯+稀硫酸 | 200g | 150g | 150g |
| 加入的钢铁样品 | 9g | 9g | 14g |
| 充分反应后,烧杯+剩余物 | 208.7g | 158.7g | 163.7g |
(1)所取的稀硫酸与钢铁样品恰好完全反应的是
(2)该钢铁样品中含铁的质量分数为多少?