题目内容
我国化学家侯德榜发明了一种著名的纯碱生产方法----“联合制碱法”.
(1)“联合制碱法”生产过程用化学方程式可简要表示为:
①NH3+CO2+H2O=NH4HCO3
②NH4HCO3+NaCl=NaHCO3↓+NH4Cl
③2NaHCO3 = Na2CO3+H2O+CO2↑
该过程中没有涉及的基本反应类型是
(2) 第②步中加入的是磨细食盐粉,食盐磨细的目的___________ ;
从该步反应还可以获得 肥
(3)上述方法制得的纯碱产品中常含有少量的氯化钠。某研究性学习小组对刚生产出的纯碱产品进行检测。取22克该样品于烧杯中,加水将其溶解,然后逐滴加入溶质质量分数为14.6%的稀盐酸并不断振荡。
首先发生的反应是:Na2CO3+HCl=NaHCO3+NaCl;
然后发生的反应是:NaHCO3+HCl= NaCl+H2O+CO2↑.
在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图甲所示.

①请你根据图甲提供的信息,在图乙的坐标系中画出检测过程中产生CO2的质量随滴加盐酸质量的变化曲线。(标明二氧化碳质量的相应数值)
②计算该样品中纯碱的质量分数。(计算结果用百分数表示,保留到小数点后一位)
(1)置换反应
(2)加快化学反应速率或加快食盐溶解 氮
(3)①
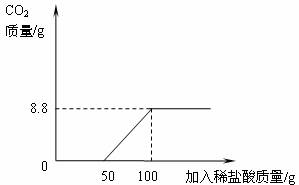
② 94.6%

练习册系列答案
相关题目