题目内容
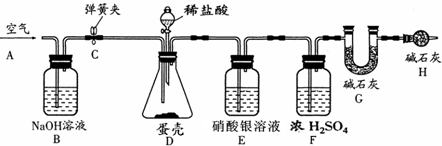
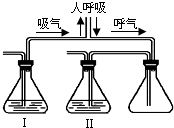 已知氢氧化钠溶液可用于吸收二氧化碳,澄清石灰水可用于检验二氧化碳,水中溶解的二氧化碳可忽略不计.人在呼吸过程中,通常是吸入空气,排出二氧化碳等气体.为了证明人呼出的气体中含有二氧化碳且二氧化碳不是来自于空气,某课外小组设计了如右图所示的实验装置.为了除去空气中的二氧化碳气体和检验人呼出气体中含有的二氧化碳,锥形瓶I、Ⅱ中加入的试剂为
已知氢氧化钠溶液可用于吸收二氧化碳,澄清石灰水可用于检验二氧化碳,水中溶解的二氧化碳可忽略不计.人在呼吸过程中,通常是吸入空气,排出二氧化碳等气体.为了证明人呼出的气体中含有二氧化碳且二氧化碳不是来自于空气,某课外小组设计了如右图所示的实验装置.为了除去空气中的二氧化碳气体和检验人呼出气体中含有的二氧化碳,锥形瓶I、Ⅱ中加入的试剂为
- A.瓶I水,瓶Ⅱ氢氧化钠溶液
- B.瓶I氢氧化钠溶液,瓶Ⅱ澄清石灰水
- C.瓶I水,瓶Ⅱ澄清石灰水
- D.瓶I澄清石灰水,瓶Ⅱ氢氧化钠溶液
B
分析:据题意知氢氧化钠溶液可以很好的吸收二氧化碳气体,所以要排除空气中二氧化碳的干扰应用氢氧化钠溶液吸收二氧化碳.澄清石灰水可用来检验二氧化碳气体的存在.
解答:
观察图示可知,I中应放能吸收空气中二氧化碳的氢氧化钠溶液;II中放石灰水,用来检测呼出气体中含有的二氧化碳.
故选B.
点评:本题考查氢氧化钠溶液的吸水性和石灰水能检验二氧化碳的性质特点,并培养同学们根据图示提取有效信息的能力.
分析:据题意知氢氧化钠溶液可以很好的吸收二氧化碳气体,所以要排除空气中二氧化碳的干扰应用氢氧化钠溶液吸收二氧化碳.澄清石灰水可用来检验二氧化碳气体的存在.
解答:
观察图示可知,I中应放能吸收空气中二氧化碳的氢氧化钠溶液;II中放石灰水,用来检测呼出气体中含有的二氧化碳.
故选B.
点评:本题考查氢氧化钠溶液的吸水性和石灰水能检验二氧化碳的性质特点,并培养同学们根据图示提取有效信息的能力.

练习册系列答案
相关题目

 水是人及一切生物生存所必需的,为了人类和社会的可持续发展,我们应该了解一些有关水的知识.请回答:
水是人及一切生物生存所必需的,为了人类和社会的可持续发展,我们应该了解一些有关水的知识.请回答: