题目内容
某兴趣小组对Zn、Ni(镍)、Cu的金属活动性顺序展开了探究.【提出假设】对三种金属的活动性顺序提出可能的假设①Zn>Ni>Cu;②Zn>Cu>Ni你觉得还有其他的可能性吗?请把它们写出来(一种即可)假设③ …
【查阅资料】小红同学查阅了部分含镍化合物的溶解性如下表,且得知镍能与酸反应.
 | 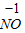 3 3 |  4 4 | 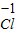 | |
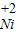 | 不 | 溶 | 溶 | 溶 |
【记录现象】请帮助小红把实验现象填写完整.
| 金属 | Ni | Zn | Cu |
| 与盐酸反应的现象 | 气体产生缓慢 金属逐渐溶解 | 气体产生激烈 金属迅速溶解 |
写出镍与盐酸反应的化学方程式
【结论应用】
请选择另一类别的一种试剂设计实验,也同样达到一次验证上述假设的正确与否,写出你选择的试剂的化学式 .
【答案】分析:金属活动性的探究题,首先要依据课本中金属活动性顺序表进行判断,氢前边的金属会与稀硫酸、盐酸反应产生氢气,但氢后边的金属不会与稀硫酸、盐酸反应产生氢气,位于前边的金属会把后边的金属从其盐溶液中置换出来,Zn的活动性比Cu的强,然后利用题干叙述的内容,从中提取有用的信息,完成这三种金属的活动性探究.
解答:解:(1)根据给出的金属,已知Zn的活动性强于Cu的,Ni的活动性未知,可以猜测三种金属的活动性Ni的可能还强于Zn的,故本题答案为:Ni>Zn>Cu;
(2)【记录现象】依据铜在金属活动性顺序中排在氢的后面,不能置换出酸中的氢,故铜片与盐酸混合无明显现象,所以本题答案为:
(3)【得出结论】根据题干提供的信息,Ni与盐酸反应产生气体缓慢,而Zn与盐酸反应产生气体激烈,可以判断Zn比Ni活泼,故猜想①正确,根据查阅的资料,Ni显正二价,故与盐酸反应时生成二价镍盐,同时生成氢气,所以本题的答案为:①; Ni+2HCl=NiCl2 +H2↑
(4)选择试剂验证金属的活动性顺序,一是利用金属与酸的反应,二是利用金属与盐溶液的反应,即位于前边的金属会把后边的金属从其盐溶液中置换出来,反之不行,所以本题答案为:NiCl2.
点评:本题考查了金属活动性顺序,要会利用金属活动顺序表设计实验,去验证金属活动性强弱.氢前边的金属会与稀硫酸、盐酸反应产生氢气,但氢后边的金属不会与稀硫酸、盐酸反应产生氢气,位于前边的金属会把后边的金属从其盐溶液中置换出来.
解答:解:(1)根据给出的金属,已知Zn的活动性强于Cu的,Ni的活动性未知,可以猜测三种金属的活动性Ni的可能还强于Zn的,故本题答案为:Ni>Zn>Cu;
(2)【记录现象】依据铜在金属活动性顺序中排在氢的后面,不能置换出酸中的氢,故铜片与盐酸混合无明显现象,所以本题答案为:
| 金属 | Ni | Zn | Cu |
| 无明显现象 |
(4)选择试剂验证金属的活动性顺序,一是利用金属与酸的反应,二是利用金属与盐溶液的反应,即位于前边的金属会把后边的金属从其盐溶液中置换出来,反之不行,所以本题答案为:NiCl2.
点评:本题考查了金属活动性顺序,要会利用金属活动顺序表设计实验,去验证金属活动性强弱.氢前边的金属会与稀硫酸、盐酸反应产生氢气,但氢后边的金属不会与稀硫酸、盐酸反应产生氢气,位于前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
相关题目
某兴趣小组对Zn、Ni(镍)、Cu的金属活动性顺序展开了探究.
【提出假设】对三种金属的活动性顺序提出可能的假设①Zn>Ni>Cu;②Zn>Cu>Ni你觉得还有其他的可能性吗?请把它们写出来(一种即可)假设③ …
【查阅资料】小红同学查阅了部分含镍化合物的溶解性如下表,且得知镍能与酸反应.
【设计实验】同温下,取大小、厚度相同的这三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象.
【记录现象】请帮助小红把实验现象填写完整.
【得出结论】原假设中正确的是 填序号).
写出镍与盐酸反应的化学方程式
【结论应用】
请选择另一类别的一种试剂设计实验,也同样达到一次验证上述假设的正确与否,写出你选择的试剂的化学式 .
【提出假设】对三种金属的活动性顺序提出可能的假设①Zn>Ni>Cu;②Zn>Cu>Ni你觉得还有其他的可能性吗?请把它们写出来(一种即可)假设③ …
【查阅资料】小红同学查阅了部分含镍化合物的溶解性如下表,且得知镍能与酸反应.
 | 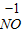 3 3 | 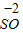 4 4 |  | |
 | 不 | 溶 | 溶 | 溶 |
【记录现象】请帮助小红把实验现象填写完整.
| 金属 | Ni | Zn | Cu |
| 与盐酸反应的现象 | 气体产生缓慢 金属逐渐溶解 | 气体产生激烈 金属迅速溶解 |
写出镍与盐酸反应的化学方程式
【结论应用】
请选择另一类别的一种试剂设计实验,也同样达到一次验证上述假设的正确与否,写出你选择的试剂的化学式 .
(2011?灌云县模拟)某兴趣小组对Zn、Ni(镍)、Cu的金属活动性顺序展开了探究.
【提出假设】对三种金属的活动性顺序提出可能的假设①Zn>Ni>Cu;②Zn>Cu>Ni你觉得还有其他的可能性吗?请把它们写出来(一种即可)假设③…
【查阅资料】小红同学查阅了部分含镍化合物的溶解性如下表,且得知镍能与酸反应.
【设计实验】同温下,取大小、厚度相同的这三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象.
【记录现象】请帮助小红把实验现象填写完整.
【得出结论】原假设中正确的是填序号).
写出镍与盐酸反应的化学方程式
【结论应用】
请选择另一类别的一种试剂设计实验,也同样达到一次验证上述假设的正确与否,写出你选择的试剂的化学式.
【提出假设】对三种金属的活动性顺序提出可能的假设①Zn>Ni>Cu;②Zn>Cu>Ni你觉得还有其他的可能性吗?请把它们写出来(一种即可)假设③…
【查阅资料】小红同学查阅了部分含镍化合物的溶解性如下表,且得知镍能与酸反应.
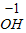 |  3 3 |  4 4 |  | |
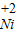 | 不 | 溶 | 溶 | 溶 |
【记录现象】请帮助小红把实验现象填写完整.
| 金属 | Ni | Zn | Cu |
| 与盐酸反应的现象 | 气体产生缓慢 金属逐渐溶解 | 气体产生激烈 金属迅速溶解 |
写出镍与盐酸反应的化学方程式
【结论应用】
请选择另一类别的一种试剂设计实验,也同样达到一次验证上述假设的正确与否,写出你选择的试剂的化学式.



