题目内容
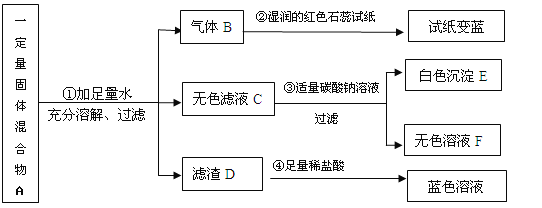
【题目】家庭中长期使用的热水壶底部有一层水垢,主要成 分是碳酸钙和氢氧化镁,可用酸溶液来清除水垢。小明同学想通过实验测定水垢中碳酸钙的含量,他将过量的稀盐酸加入到200 g水垢中(假定水垢中杂质不与酸反应),并将产生的CO2气体全部通入到足量的NaOH溶液中(不考虑盐酸的挥发性),NaOH溶液增加的质量与反应时间的关系如图所示,
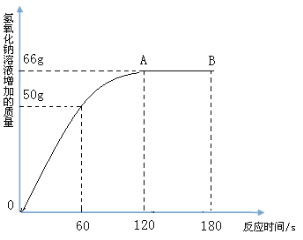
试根据题意回答下列问题:
(1)在滴入稀盐酸的过程中,观察到的一项明显现象是 。
(2)从图中可知,NaOH溶液吸收的CO2气体的总质量为_______g。
(3)在水垢中加入稀盐酸时,所发生的中和反应的化学方程式为 。
(4)计算水垢中碳酸钙的质量分数(写出相应的计算过程,结果精确到0.1%)。
【答案】(1)冒气泡或固体溶解
(2)66
(3)Mg(OH)2+ 2HCl = MgCl2+2H2O
(4)75.0%
【解析】
试题分析:滴入盐酸后会和水垢的主要成分碳酸钙反应产生二氧化碳气体,所以现象是有气泡冒出;从图中可知,NaOH溶液吸收的CO2气体的总质量为66克,因为氢氧化钠和二氧化碳反应使得氢氧化钠的质量增大,一直到反应结束,质量就不再变化了;其中水垢中的氢氧化镁属于碱,盐酸属于酸,二者反应属于中和反应。解:设水垢中碳酸钙的质量为x。
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
100 44
X 66g
列比例式得: 100 / x = 44 / 66 g
x=150g
150g/200g×100% ==75.0%

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】(6分)现甲、乙两化学小组安装两套下图所示相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素。
(1)下列方法不能检查该装置气密性的是______。
A.将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏
斗颈部能形成稳定的水柱,则气密性良好,反之气密性差。
B.关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差。
C.关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差。
(2)甲小组有如下实验设计方案,完成下表。
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 探究 对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2 |
甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
(3)甲、乙两小组得出如图数据。
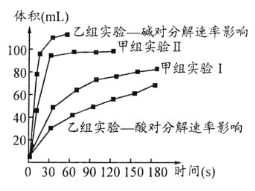
①由甲组实验得出的数据可知:浓度越大,H2O2分解速率 。
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析:相同条件下, H2O2在 (填“酸性”或“碱性”)环境下放出气体速率较快;乙组提出可以用Ba02固体与硫酸溶液反应制H202(已知还生成另一种物质),其化学反应方程式为 ;支持这一方案的理由是 。