题目内容
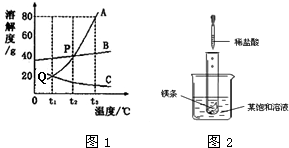
 图1是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:
图1是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:(1)t2℃时,A、B、C三种物质的溶解度大小关系是
A=B>C(或C<A=B)
A=B>C(或C<A=B)
.(2)t3℃时,将30gA物质加入到50g水中,充分溶解后,所得溶液是
不饱和
不饱和
(选填“饱和”或“不饱和”)溶液.(3)室温下,将盛有A的饱和溶液的试管放入盛水的烧杯中,再向烧杯内的水中加入一定量的NH4NO3并搅拌(如图2),试管内可以观察到的现象是
有A析出
有A析出
.分析:(1)据溶解度曲线可比较同一温度下不同物质的溶解度大小;
(2)据该温度下A的溶解度分析所加溶质是否能全部溶解,进而判断溶液是否饱和;
(3)NH4NO3溶于水使溶液的温度降低,A的溶解度随温度的降低而减小,据此分析解答.
(2)据该温度下A的溶解度分析所加溶质是否能全部溶解,进而判断溶液是否饱和;
(3)NH4NO3溶于水使溶液的温度降低,A的溶解度随温度的降低而减小,据此分析解答.
解答:解:(1)由溶解度曲线可知:t2℃时,A、B、C三种物质的溶解度大小关系是A=B>C(或C<A=B);
(2)t3℃时A的溶解度是80g,即100g水中最多溶解80g的A,所以将30gA物质加入到50g水中,充分溶解后,最多溶解40g,故所得溶液是不饱和溶液;
(3)室温下,将盛有A的饱和溶液的试管放入盛水的烧杯中,再向烧杯内的水中加入一定量的NH4NO3并搅拌,NH4NO3溶于水使溶液的温度降低,A的溶解度随温度的降低而减小,所以试管中A的饱和溶液会因温度降低、溶解度减小而有A析出;
故答案为:(1)A=B>C(或C<A=B);(2)不饱和;(3)有A析出.
(2)t3℃时A的溶解度是80g,即100g水中最多溶解80g的A,所以将30gA物质加入到50g水中,充分溶解后,最多溶解40g,故所得溶液是不饱和溶液;
(3)室温下,将盛有A的饱和溶液的试管放入盛水的烧杯中,再向烧杯内的水中加入一定量的NH4NO3并搅拌,NH4NO3溶于水使溶液的温度降低,A的溶解度随温度的降低而减小,所以试管中A的饱和溶液会因温度降低、溶解度减小而有A析出;
故答案为:(1)A=B>C(或C<A=B);(2)不饱和;(3)有A析出.
点评:本题主要考查了对溶解度概念的理解,溶解度曲线的认识和应用,难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目

 (1)请你各举出一个实例,说明下列有关溶液的叙述是错误的.
(1)请你各举出一个实例,说明下列有关溶液的叙述是错误的.