题目内容
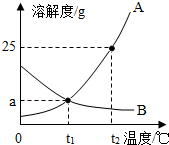 如图为A、B两种固体物质的溶解度曲线.
如图为A、B两种固体物质的溶解度曲线.(1)在
t1
t1
℃时,A、B两种物质的溶解度相等.(2)t2℃时,A物质饱和溶液中溶质的质量分数为
20%
20%
.若要把该饱和溶液125g稀释成质量分数为10%的溶液,应加水125
125
g.(3)t2℃时,分别将恰好饱和的A、B两种物质的溶液降温至t1℃,溶质的质量分数保持不变的是
B
B
.此时属于饱和溶液的是A
A
.分析:(1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)饱和溶液中溶质的质量分数=
×100%,溶液稀释前后溶质的质量不变;
(3)据AB的溶解度随温度的变化情况及溶质的质量分数计算方法分析解答.
(2)饱和溶液中溶质的质量分数=
| 溶解度 |
| 溶解度+100g |
(3)据AB的溶解度随温度的变化情况及溶质的质量分数计算方法分析解答.
解答:解:(1)t1℃时A和B的溶解度曲线交于一点,二者的溶解度相等;
(2)t2℃时A的溶解度是25g,所以甲的饱和溶液中溶质的质量分数为:
×100%=20%;若要把该饱和溶液稀释成质量分数为10%的溶液,设应加水的质量为x,则有(x+125g)×10%=125g×20%,解得x=125g;
(3)A的溶解度随温度的降低而减小,B的溶解度随温度的降低而增大,所以t2℃时,分别将恰好饱和的A、B两种物质的溶液降温至t1℃,甲析出晶体,溶质的质量减小,溶质的质量分数减小,依然是饱和溶液,B溶解度增大,变为不饱和溶液,溶质的质量分数保持不变;
故答案为:(1)t1; (2)20%; 125;(3)B; A.
(2)t2℃时A的溶解度是25g,所以甲的饱和溶液中溶质的质量分数为:
| 25g |
| 125g |
(3)A的溶解度随温度的降低而减小,B的溶解度随温度的降低而增大,所以t2℃时,分别将恰好饱和的A、B两种物质的溶液降温至t1℃,甲析出晶体,溶质的质量减小,溶质的质量分数减小,依然是饱和溶液,B溶解度增大,变为不饱和溶液,溶质的质量分数保持不变;
故答案为:(1)t1; (2)20%; 125;(3)B; A.
点评:本题考查了对溶解度概念的了解、溶解度曲线的意义和应用,及饱和溶液中溶质质量分数的计算方法,能较好考查学生分析解决问题的能力,要使溶液溶质的质量分数减半,加入水的质量=原溶液的质量.

练习册系列答案
相关题目
 (1)某原子结构示意图为
(1)某原子结构示意图为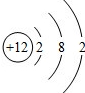 该原子核内有
该原子核内有(2)世界上的物质都是由粒子构成的,仿照示例填空
| 物质名称 | 示例:水 | 铁 | 氯化钠 | |
| 构成物质的粒子 | 分子 | 分子 |
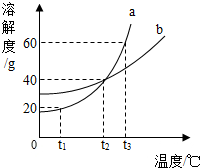
根据该图可知:在t3℃时,a物质的溶解度是
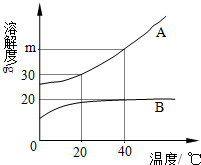 如图为A、B两种固体物质的溶解度曲线.试根据图中所给信息回答下列问题:
如图为A、B两种固体物质的溶解度曲线.试根据图中所给信息回答下列问题: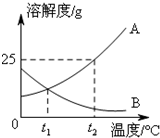 如图为A、B两种固体物质的溶解度曲线.
如图为A、B两种固体物质的溶解度曲线. 如图为A、B两种固体物质的溶解度曲线.请回答:
如图为A、B两种固体物质的溶解度曲线.请回答: 如图为A、B两种固体物质的溶解度曲线.从图中你还可获得哪些信息?请你写出其中的两条:
如图为A、B两种固体物质的溶解度曲线.从图中你还可获得哪些信息?请你写出其中的两条: