题目内容
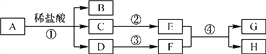
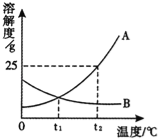
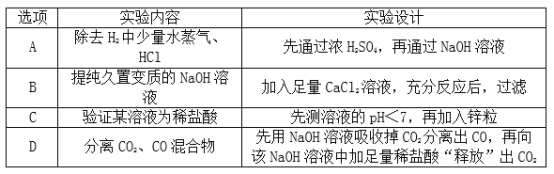
【题目】分离、除杂、提纯和检验是化学实验的重要环节。下面实验设计能够达到目的的是( )
A. A B. B C. C D. D
【答案】D
【解析】A、除去H2中少量水蒸气、HCl,应先通过NaOH溶液,除去氯化氢气体,再通过浓H2SO4,除去水蒸气,否则会再次引入新的杂质气体水蒸气,不能够达到目的;B、久置变质的NaOH溶液在含有碳酸钠,碳酸钠与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,能除去杂质但引入了新的杂质氯化钠,不能够达到目的;C、先测溶液的pH<7,说明溶液显酸性;再加入锌粒,有气泡产生,说明溶液显酸性,但不能证明含有盐酸,也可能是硫酸等,不能够达到目的;D、二氧化碳能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,先用NaOH溶液吸收掉CO2分离出CO,再向该NaOH溶液加足量稀盐酸,碳酸钠能与稀盐酸反应生成二氧化碳气体,“释放”出CO2,能够达到目的。故选D。

【题目】分析处理图表的信息是学习化学的一种重要方法。下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
温度/℃ | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
(1)40 ℃时,氯化钠的溶解度为________g。
(2)碳酸钠的溶解度随温度的升高而________(填“增大”或“减小”)。在20 ℃时,在100 g的水中加入30 g碳酸钠,充分搅拌后得到的是________(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30 ℃,该溶液的溶质质量分数为________(计算结果精确到0.1%)。
(3)10 ℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是________________________________________________________________________。