题目内容
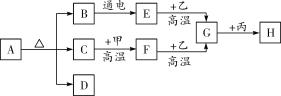
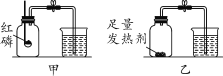
【题目】实验室废液中含有硝酸银、硝酸铜,实验小组利用稀硝酸和铁粉分离回收银和铜,设计如下方案。先在废液中加入过量的铁粉,充分反应后过滤得到滤渣A,其成分为银、铜和铁,再对滤渣A按如图流程处理:

(1)写出滤液C中主要成分的化学式_____。
(2)写出CuO与H2SO4反应的化学方程式________,其基本反应类型是____。
(3)滤液D中溶质的成分有(填化学式)______。
【答案】FeSO4 CuO+H2SO4= CuSO4+H2O 复分解反应 CuSO4、H2SO4
【解析】
(1)已知滤渣A的成分为银、铜和铁,加入适量的H2SO4后,只有Fe与H2SO4反应,生成FeSO4和H2。(2)硫酸和氧化铜反应的化学方程式为CuO+H2SO4=== CuSO4+H2O;其基本反应类型是复分解反应。(3)氧化铜和硫酸反应生成硫酸铜,化学式为CuSO4,滤液中还有过量的硫酸,化学式为H2SO4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】金属是应用非常广泛的一类材料,如何防止铁的锈蚀是工业研究的重点内容。某化学兴趣小组的同学进行了如下探究:
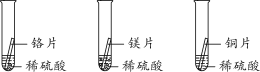
探究一:如图进行实验,经过一周后观察,试管A和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀。
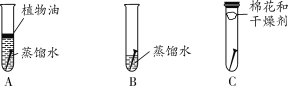
(分析)(1)A中加入的蒸馏水要事先煮沸,其目的是______________。
(2)根据上述实验可得出的结论是____________________________________。
探究二:探究影响铁锈蚀速率的因素
(实验与现象)
序号 | 实验内容 | 实验现象 |
1 | 常温下将铁丝放在潮湿的空气中一小时 | 铁丝表面依然光亮 |
2 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
3 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
4 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
5 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 | 铁丝表面灰暗程度比实验4严重 |
(分析与结论)(1)对比实验3、4可得出的结论是________________________。
(2)由该实验可知,可以影响铁锈蚀速率的因素是________________________。
(反思)若铁锈的成分是一种红褐色的碱类物质,请写出铁生锈的化学方程式________________________________,所以日常生活中常要保持铁制品________。
(拓展与应用)取暖贴的工作原理是利用铁生锈产生热量,取暖贴药剂的主要成分是铁粉、氯化钠和活性炭粉。其中氯化钠的作用是________________________。