题目内容
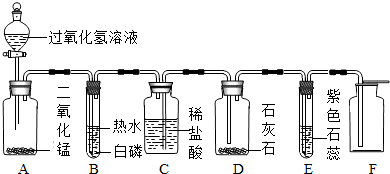
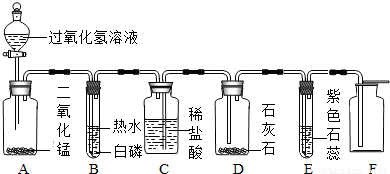
小芳设计了如下气体制取与性质验证的组合装置.打开分液漏斗活塞放出一定量过氧化氢溶液后,关上活塞,A中出现大量气泡,B中白磷燃烧,C中液面下降,稀盐酸逐渐进入D中.请看图回答问题:
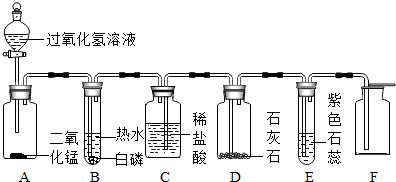
(1)B中白磷能够在水下燃烧的原因是
(2)D中发生反应的化学方程式为
(3)E中的实验现象是
(4)用F装置收集气体的依据是

(1)B中白磷能够在水下燃烧的原因是
A中生成O2进入B中,热水中的白磷达到着火点,同时遇到氧气,因此能在水下燃烧
A中生成O2进入B中,热水中的白磷达到着火点,同时遇到氧气,因此能在水下燃烧
(2)D中发生反应的化学方程式为
CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
.(3)E中的实验现象是
试液变红
试液变红
.(4)用F装置收集气体的依据是
CO2的密度大于空气的密度
CO2的密度大于空气的密度
.分析:根据已有的知识进行分析,燃烧需要可燃物与氧气接触且温度达到可燃物的着火点,紫色石蕊试液与酸性溶液变红,F收集的气体需要密度比空气大,碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳.
解答:解:(1)过氧化氢分解生成的氧气进入B中,提供了燃烧所需要的氧气,达到了白磷燃烧的条件,因此B中白磷能够在水下燃烧;
(2)A中生成的氧气使装置内的压强增大,能将盐酸压入D中,使盐酸与碳酸钙反应生成氯化钙、水和二氧化碳气体,反应的方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)二氧化碳进入E中,二氧化碳的水溶液呈酸性,能使石蕊试液变红;
(4)F是向上排空气法收集气体,能使用此法收集的气体需要具备密度比空气大的性质;
故答案为:(1)A中生成O2 进入B中,热水中的白磷达到着火点,同时遇到氧气,因此能在水下燃烧;(2)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)试液变红;(4)CO2的密度大于空气的密度.
(2)A中生成的氧气使装置内的压强增大,能将盐酸压入D中,使盐酸与碳酸钙反应生成氯化钙、水和二氧化碳气体,反应的方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)二氧化碳进入E中,二氧化碳的水溶液呈酸性,能使石蕊试液变红;
(4)F是向上排空气法收集气体,能使用此法收集的气体需要具备密度比空气大的性质;
故答案为:(1)A中生成O2 进入B中,热水中的白磷达到着火点,同时遇到氧气,因此能在水下燃烧;(2)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)试液变红;(4)CO2的密度大于空气的密度.
点评:本题考查了气体的制取和气体的性质,因此掌握氧气的反应原理、制取和收集方法;掌握二氧化碳的实验室制法及其物理性质和化学性质;注意燃烧与燃烧的条件是解题的关键.

练习册系列答案
相关题目