题目内容
某化学小组在测定一种赤铁矿样品中氧化铁的质量分数时,称取2.0g赤铁矿样品与足量的一氧化碳充分反应(假定赤铁矿样品中杂质不参加反应),测得生成二氧化碳的质量为1.32g.请计算:该赤铁矿样品中氧化铁的质量分数.
解:设参加反应的氧化铁的质量是x
3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
160 132
x 1.32g
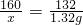
x=1.6g
故该赤铁矿样品中氧化铁的质量分数为 =80%
=80%
答:该赤铁矿样品中氧化铁的质量分数为80%.
分析:依据生成的二氧化碳质量利用反应的方程式即可求出样品中氧化铁的质量,从而可的答案;
点评:此题是利用化学方程式的计算难度很小,在计算要正确的运用所给数据,计算准确,注意解题的格式和步骤是此题的关键点.
3CO+Fe2O3
 2Fe+3CO2
2Fe+3CO2160 132
x 1.32g
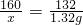
x=1.6g
故该赤铁矿样品中氧化铁的质量分数为
 =80%
=80%答:该赤铁矿样品中氧化铁的质量分数为80%.
分析:依据生成的二氧化碳质量利用反应的方程式即可求出样品中氧化铁的质量,从而可的答案;
点评:此题是利用化学方程式的计算难度很小,在计算要正确的运用所给数据,计算准确,注意解题的格式和步骤是此题的关键点.

练习册系列答案
相关题目