题目内容
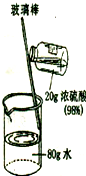
 (1)浓硫酸具有很强的腐蚀性,溶于水会放出大量的热,配制稀硫酸时应注意安全.图表示稀释浓硫酸的正确操作,请进行下列有关计算:
(1)浓硫酸具有很强的腐蚀性,溶于水会放出大量的热,配制稀硫酸时应注意安全.图表示稀释浓硫酸的正确操作,请进行下列有关计算:(2)20g溶质质量分数为98%的浓硫酸所含溶质的质量为
19.6
19.6
g.(3)将20g98%的浓硫酸注入80g水中,形成的稀硫酸的质量为
100
100
g,其中溶质的质量分数为19.6%
19.6%
.(4)钛(Ti)是一种重要金属,它可由钠(Na)和四氯化钛(TiCl4)在一定条件下反应制得,该反应的化学方程式为:TiCl4+4Na═Ti+4NaCl.欲制取钛24kg,需要原料四氯化钛的质量为多少?
分析:(2)根据溶液中溶质的质量分数的计算公式进行解答即可;
(3)根据溶液稀释前后溶质的质量不变来进行解答;
(4)根据钛的质量结合反应的化学方程式可以计算出四氧化三钛的质量;
(3)根据溶液稀释前后溶质的质量不变来进行解答;
(4)根据钛的质量结合反应的化学方程式可以计算出四氧化三钛的质量;
解答:解:(2)20g溶质质量分数为98%的浓硫酸所含溶质的质量为:20g×98%=19.6g;
(3)将20g98%的浓硫酸注入80g水中,形成的稀硫酸的质量为20g+80g=100g
其中溶质的质量分数为:
×100%=19.6%.
(4)设需要原料四氯化钛的质量为x
TiCl4+4Na═Ti+4NaCl
160 48
x 24kg
=
解得:x=80kg
答:需要原料四氯化钛的质量为80kg.
故答案为:(2)19.6g;
(3)100;19.6%.
(4)80kg
(3)将20g98%的浓硫酸注入80g水中,形成的稀硫酸的质量为20g+80g=100g
其中溶质的质量分数为:
| 20g×98% |
| 100g |
(4)设需要原料四氯化钛的质量为x
TiCl4+4Na═Ti+4NaCl
160 48
x 24kg
| 160 |
| x |
| 48 |
| 24kg |
解得:x=80kg
答:需要原料四氯化钛的质量为80kg.
故答案为:(2)19.6g;
(3)100;19.6%.
(4)80kg
点评:溶液中溶质质质量分数的有关计算,是三大基本计算类型之一,解决该类问题的关键是要抓住溶质守恒,即寻找溶质的来源和去向.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
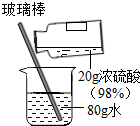 浓硫酸具有很强的腐蚀性,溶于水会放出大量的热,配制稀硫酸时 应注意安全.如图表示稀释浓硫酸的正确操作,请进行下列有关计算:
浓硫酸具有很强的腐蚀性,溶于水会放出大量的热,配制稀硫酸时 应注意安全.如图表示稀释浓硫酸的正确操作,请进行下列有关计算: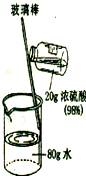 (1)浓硫酸具有很强的腐蚀性,溶于水会放出大量的热,配制稀硫酸时应注意安全.图表示稀释浓硫酸的正确操作,请进行下列有关计算:
(1)浓硫酸具有很强的腐蚀性,溶于水会放出大量的热,配制稀硫酸时应注意安全.图表示稀释浓硫酸的正确操作,请进行下列有关计算: