题目内容
【题目】某纯碱样品中含有少量氯化钠.为测定样品中碳酸钠的质量分数,现称取该样品11g,加入到盛有50g稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为56.6g.计算:
(1)纯碱样品中碳酸钠的质量分数;
(2)反应后所得溶液的溶质质量分数.
【答案】
(1)解:生成二氧化碳的质量为11g+50g﹣56.6g=4.4g
设样品中碳酸钠的质量为x,生成的氯化钠是y.
Na2CO3+2HCl= | 2NaCl+H2O+ | CO2↑ |
106 | 117 | 44 |
x | y | 4.4g |
![]()
![]()
解得,x=10.6g y=11.7g
碳酸钠的质量分数= ![]() ×100%≈96.4%
×100%≈96.4%
答:样品中碳酸钠的质量分数为96.4%
(2)解:所得溶液中NaCl的质量为原样品中氯化钠的质量与生成氯化钠的质量之和.
氯化钠的质量=11.7g+(11g﹣10.6g)=12.1g
溶液的质量=56.6g
所得溶液的溶质质量分数= ![]() ×100%≈21.4%
×100%≈21.4%
答:反应后所得溶液中溶质的质量分数21.4%
【解析】(1)由题意求出二氧化碳的质量,然后根据碳酸钠与盐酸反应的化学方程式可以计算出样品中碳酸钠的质量分数.(2)反应后所得溶液为氯化钠溶液,而样品中的氯化钠不与盐酸反应;至完全反应后,所得溶液为氯化钠溶液,其溶质氯化钠由两部分组成:一部分为原混合物质中的氯化钠,另一部分则是反应生成的氯化钠;

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】分类和类比是学习化学常用的方法.
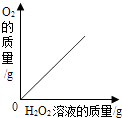
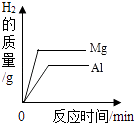
(1)化学实验按其研究内容可分为:化学基本操作的实验、物质的性质的实验、揭示化学基本概念和原理(定律)的实验等. 据此应将下列实验中的B与(填两项)归为一类,依据是 .
|
|
|
|
|
A | B | C | D | E |
(2)通过观察表格中的信息,根据元素的化合价与原子的最外层电子数的关系,你能发现有关元素化合价的规律是 . 应用此规律你能推测出磷元素的最低负价是 , 磷酸中磷元素显+5价,则磷酸的化学式为 .
元素名称 | 最高正化合价 | 最低负化合价 |
硫 | +6 | ﹣2 |
氯 | +7 | ﹣1 |