题目内容
【题目】下表是Ca(OH)2和NaOH的溶解度数据.请回答下列问题:![]()
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是(填A或B).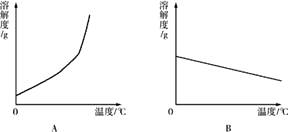
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰.
其中措施正确的是( )
A.②④⑥
B.③④
C.①③⑤⑥
D.①②⑤⑥
(3)20℃时,191 g饱和NaOH溶液,蒸发10 g水后,再降温到20℃,可析出NaOH晶体的质量为 .
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数乙甲(填“>”、“<”或“=”).
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是 .
(6)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH (填“偏大”、“偏小”或“不受影响”).
【答案】
(1)A
(2)D
(3)9.1g
(4)<
(5)降温结晶,过滤
(6)偏小
【解析】氢氧化钙的溶解能力随温度的升高而减小,要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:升高温度、蒸发水后再恢复到原温度、加入氢氧化钙;20℃时,191g饱和NaOH溶液,有氢氧化钠91g,水100g,每10g水溶解9.1g氢氧化钠,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为9.1g;氢氧化钙的溶解能力随温度的升高而减小,氢氧化钠的溶解能力随温度的升高而增大,含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是降温结晶;将pH试纸用蒸馏水润湿,会稀释氢氧化钠溶液,减小变弱,pH变小.
所以答案是:(1)A;(2)D;(3)9.1g;(4)<;(5)降温结晶,过滤;(6)偏小.
【考点精析】解答此题的关键在于理解饱和溶液和不饱和溶液相互转变的方法的相关知识,掌握饱和和不饱和的转变方法:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低②最可靠的方法是:加溶质、蒸发溶剂,以及对固体溶解度曲线及其作用的理解,了解1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).

【题目】某化学探究小组欲制取少量氢氧化钠溶液,他们把饱和石灰水加入盛有碳酸钠溶液的烧杯中,经充分搅拌、过滤,得到样品溶液.
(1)写出反应的化学方程式:.
(2)小组同学对得到的样品溶液是否为纯净的氢氧化钠溶液产生怀疑,决定对其溶质成份进行探究.
【提出猜想】
猜想一:只含氢氧化钠
猜想二:含有氢氧化钠、氢氧化钙
猜想三:含有氢氧化钠、碳酸钠
【实验探究】小组同学发现,只要用反应物(饱和石灰水和碳酸钠溶液)就可以验证猜想.
实验操作 | 实验现象 | 实验结论 |
| 猜想二不正确 | |
| 猜想三正确 |
他们取少量样品溶液进行下列实验:
(3)【交流讨论】甲同学认为要验证猜想二不正确,也可往样品溶液中通入;受该同学的启发,小组同学认为要验证猜想三正确,也可在样品溶液中滴加盐酸.
(4)【实验评价】乙同学往样品溶液中滴入盐酸,刚开始并没有观察到明显现象,试分析原因.
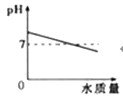
【题目】下列图象中能正确表示其变化过程的是( )
|
|
A.向pH=10的KOH溶液中不断加水稀释 | B.一定质量KClO3和MnO2混合物制O2 |
|
|
C.向FeCl3和HNO3的混合溶液中加入NaOH溶液直至过量 | D.20℃时,向一定质量的NaCl溶液中加入KNO3固体 |
A.A
B.B
C.C
D.D