题目内容
小强同学从旅游云南大理矿区取回了若干块矿石样品.(1)玲玲同学拿了一块在家做实验(如图所示),杯底放一支小蜡烛和样品粉末,沿杯壁缓缓倒入一定量的醋(含有3%~5%的醋酸).他能观察到的现象有:
①______;
②______.
(2)在老师的指导下对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应).请计算:
| 序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
| 第1次 | 10 | 5.5 |
| 第2次 | 10 | m |
| 第3次 | 10 | 1.2 |
| 第4次 | 10 | 1.2 |
②样品中碳酸钙的质量分数是______;
③上表中m的数值应为______;
④老师的问题:要得到3.3kg的CO2,需要质量分数为80%的石灰石多少千克?
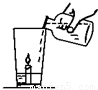
【答案】分析:(1)大理石的主要成分碳酸钙和醋酸反应生成二氧化碳气体,根据二氧化碳的性质可以判断蜡烛是否熄灭.
(2)比较第三次和的四次的数据可知:样品中杂质的质量为1.2g,结合样品的质量就可以计算出样品中碳酸钙的质量分数.
比较第一次和第三次的数据可知第一次中盐酸完全反应,消耗碳酸钙8g-5.5g=2.5g,因此第二次中也是消耗2.5g碳酸钙,所以用第一次的剩余固体质量减去第二次消耗的碳酸钙的质量就是第二次剩余固体的质量.
由生成二氧化碳的质量和石灰石中碳酸钙的质量分数,根据碳酸钙分解的化学方程式就可以计算出需要石灰石的质量.
解答:解:(1)大理石的主要成分碳酸钙,碳酸钙能与醋酸反应生成二氧化碳,会观察到有气泡产生;二氧化碳不能燃烧,不支持燃烧,且密度比空气大,可观察到蜡烛会熄灭.
(2)①由表中数据可知,在第三次加入10g盐酸后,固体剩余物质量不再减少,说明剩余的1.2g固体是不与稀盐酸反应的杂质.
②m=5.5g-(8g-5.5g)=3g
③样品中碳酸钙的质量分数= 100%=85%.
100%=85%.
④设需要质量分数为80%的石灰石的质量为x
CaCO3 CaO+CO2↑
CaO+CO2↑
100 44
80%x 3.3kg
 x=9.375kg
x=9.375kg
答:要得到3.3kg的二氧化碳,需要质量分数为80%的石灰石9.375kg.
故答案为:(1)①产生大量气泡;②蜡烛熄灭;(2)①1.2;②85%;③3;④9.375kg.
点评:本题考查了碳酸钙的化学性质、根据化学反应方程式的计算、含杂质物质的化学反应的有关计算;根据化学方程式进行计算时,要注意所使用的质量必须都是纯净物的质量,不能把含杂质的物质的质量直接代入方程式进行计算.
(2)比较第三次和的四次的数据可知:样品中杂质的质量为1.2g,结合样品的质量就可以计算出样品中碳酸钙的质量分数.
比较第一次和第三次的数据可知第一次中盐酸完全反应,消耗碳酸钙8g-5.5g=2.5g,因此第二次中也是消耗2.5g碳酸钙,所以用第一次的剩余固体质量减去第二次消耗的碳酸钙的质量就是第二次剩余固体的质量.
由生成二氧化碳的质量和石灰石中碳酸钙的质量分数,根据碳酸钙分解的化学方程式就可以计算出需要石灰石的质量.
解答:解:(1)大理石的主要成分碳酸钙,碳酸钙能与醋酸反应生成二氧化碳,会观察到有气泡产生;二氧化碳不能燃烧,不支持燃烧,且密度比空气大,可观察到蜡烛会熄灭.
(2)①由表中数据可知,在第三次加入10g盐酸后,固体剩余物质量不再减少,说明剩余的1.2g固体是不与稀盐酸反应的杂质.
②m=5.5g-(8g-5.5g)=3g
③样品中碳酸钙的质量分数=
 100%=85%.
100%=85%.④设需要质量分数为80%的石灰石的质量为x
CaCO3
 CaO+CO2↑
CaO+CO2↑100 44
80%x 3.3kg
 x=9.375kg
x=9.375kg答:要得到3.3kg的二氧化碳,需要质量分数为80%的石灰石9.375kg.
故答案为:(1)①产生大量气泡;②蜡烛熄灭;(2)①1.2;②85%;③3;④9.375kg.
点评:本题考查了碳酸钙的化学性质、根据化学反应方程式的计算、含杂质物质的化学反应的有关计算;根据化学方程式进行计算时,要注意所使用的质量必须都是纯净物的质量,不能把含杂质的物质的质量直接代入方程式进行计算.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
(8分)小强同学从旅游云南大理矿区取回了若干块矿石样品。
(1)玲玲同学拿了一块在家做实验(如图所示),杯底放一支小蜡烛和样品粉末,沿杯壁缓缓倒入一定量的醋(含有3%~5%的醋酸)。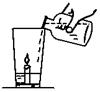
他能观察到的现象有:① ②
(2)在老师的指导下对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8 g这种石灰石样品,把40 g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)。请计算:
| 序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
| 第1次 | 10 | 5.5 |
| 第2次 | 10 | m |
| 第3次 | 10 | 1.2 |
| 第4次 | 10 | 1.2 |
②样品中碳酸钙的质量分数是 ;
③上表中m的数值应为 ;
④老师的问题:要得到3.3 kg的CO2,需要质量分数为80%的石灰石多少千克? 3分
(8分)小强同学从旅游云南大理矿区取回了若干块矿石样品。
(1)玲玲同学拿了一块在家做实验(如图所示),杯底放一支小蜡烛和样品粉末,沿杯壁缓缓倒入一定量的醋(含有3%~5%的醋酸)。
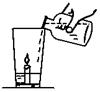
他能观察到的现象有:① ②
(2)在老师的指导下对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8 g这种石灰石样品,把40 g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)。请计算:
|
序号 |
加入稀盐酸质量(g) |
剩余固体质量(g) |
|
第1次 |
10 |
5.5 |
|
第2次 |
10 |
m |
|
第3次 |
10 |
1.2 |
|
第4次 |
10 |
1.2 |
①8 g的石灰石样品中含有杂质 克;
②样品中碳酸钙的质量分数是 ;
③上表中m的数值应为 ;
④老师的问题:要得到3.3 kg的CO2,需要质量分数为80%的石灰石多少千克? 3分
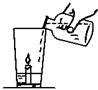 小强同学从旅游云南大理矿区取回了若干块矿石样品.
小强同学从旅游云南大理矿区取回了若干块矿石样品.
(1)玲玲同学拿了一块在家做实验(如图所示),杯底放一支小蜡烛和样品粉末,沿杯壁缓缓倒入一定量的醋(含有3%~5%的醋酸).他能观察到的现象有:
①______;
②______.
(2)在老师的指导下对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应).请计算:
| 序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
| 第1次 | 10 | 5.5 |
| 第2次 | 10 | m |
| 第3次 | 10 | 1.2 |
| 第4次 | 10 | 1.2 |
②样品中碳酸钙的质量分数是______;
③上表中m的数值应为______;
④老师的问题:要得到3.3kg的CO2,需要质量分数为80%的石灰石多少千克?
小强同学从旅游云南大理矿区取回了若干块矿石样品.
(1)玲玲同学拿了一块在家做实验(如图所示),杯底放一支小蜡烛和样品粉末,沿杯壁缓缓倒入一定量的醋(含有3%~5%的醋酸).他能观察到的现象有:
①______;
②______.
(2)在老师的指导下对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应).请计算:
①8g的石灰石样品中含有杂质______克;
②样品中碳酸钙的质量分数是______;
③上表中m的数值应为______;
④老师的问题:要得到3.3kg的CO2,需要质量分数为80%的石灰石多少千克?
(1)玲玲同学拿了一块在家做实验(如图所示),杯底放一支小蜡烛和样品粉末,沿杯壁缓缓倒入一定量的醋(含有3%~5%的醋酸).他能观察到的现象有:
①______;
②______.
(2)在老师的指导下对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应).请计算:
| 序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
| 第1次 | 10 | 5.5 |
| 第2次 | 10 | m |
| 第3次 | 10 | 1.2 |
| 第4次 | 10 | 1.2 |
②样品中碳酸钙的质量分数是______;
③上表中m的数值应为______;
④老师的问题:要得到3.3kg的CO2,需要质量分数为80%的石灰石多少千克?

 小强同学从旅游云南大理矿区取回了若干块矿石样品.
小强同学从旅游云南大理矿区取回了若干块矿石样品.