题目内容
【题目】某化学兴趣小组为了测定某石灰石样品的纯度,小组同学取出12.5g石灰石样品粉碎后盛放于烧杯中(样品中杂质不溶于水,且不与酸反应),然后往烧杯中逐渐加入稀盐酸,充分反应后产生气体的质量与反应时间的关系如图,请计算: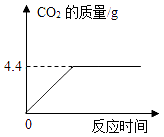
(1)石灰石样品粉碎的目的是 .
(2)石灰石样品的纯度是多少?(此问要写出计算过程)
(3)反应前后烧杯中钙元素的质量(填“变大”、“不变”或“变小”).
【答案】
(1)增大反应物的接触面积,使反应充分进行
(2)解:设该石灰石样品中CaCO3的质量为X
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 44 | ||
x | 4.4g |
![]() X=10g
X=10g
∴样品中碳酸钙的质量分数= (10g/12.5g)x100%=80%
答:该石灰石样品的纯度为80%
(3)不变
【解析】根据所学知识和题中信息知,(1)石灰石样品粉碎的目的是增大反应物的接触面积,使反应充分进行。(2)石灰石样品的纯度是∶
解:设该石灰石样品中CaCO3的质量为X
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 44 | ||
x | 4.4g |
![]() =
= ![]() , X=10g
, X=10g
样品中碳酸钙的质量分数= ![]() x100%=80% 。
x100%=80% 。
答:该石灰石样品的纯度为80%;(3)反应前后烧杯中钙元素的质量不变。
所以答案是:增大反应物的接触面积,使反应充分进行;
解:设该石灰石样品中CaCO3的质量为X
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 44 | ||
x | 4.4g |
![]() X=10g
X=10g
∴样品中碳酸钙的质量分数= (10g/12.5g)x100%=80%
答:该石灰石样品的纯度为80%。
不变。
【考点精析】利用根据化学反应方程式的计算对题目进行判断即可得到答案,需要熟知各物质间质量比=系数×相对分子质量之比.

【题目】NaNO3和KNO3的溶解度数据及溶解度曲线如下,下列说法正确的是( )

温度/℃ | 20 | 30 | 50 | 60 | 80 | |
溶解度S/g | NaNO3 | 87.6 | 94.9 | 110 | 122 | 148 |
KNO3 | 31.6 | 45.3 | 85.5 | 110 | 167 |
A.30℃时,饱和溶液的溶质质量分数:NaNO3>KNO3
B.乙表示KNO3溶解度曲线
C.t1℃时NaNO3和KNO3的溶解度相等,此时温度为60﹣80℃之间
D.阴影处NaNO3和KNO3的溶液均为饱和溶液