题目内容
 某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,并进行中和反应的有关实验.请你与他们一起完成以下探究活动:
某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,并进行中和反应的有关实验.请你与他们一起完成以下探究活动:[对固体猜想]
猜想I:全部是Na2CO3,猜想的依据是
CO2+2NaOH=Na2CO3+H2O(或空气中的CO2与NaOH反应生成Na2CO3)
CO2+2NaOH=Na2CO3+H2O(或空气中的CO2与NaOH反应生成Na2CO3)
;猜想Ⅱ:全部是NaOH
猜想Ⅲ:部分是NaOH,部分是Na2CO3.
[实验和推断]
(1)若现象A为有气泡产生,则加入的X溶液是
稀盐酸(或稀硫酸等)
稀盐酸(或稀硫酸等)
,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式是Na2CO3+2HCl=2NaCl+H2O+CO2↑(与所选的酸对应,合理均可)
Na2CO3+2HCl=2NaCl+H2O+CO2↑(与所选的酸对应,合理均可)
.(2)若X是Ca(OH)2溶液,现象A有白色沉淀,现象B为无色酚酞试液变红色,则白色沉淀为
CaCO3
CaCO3
(填化学式),该实验不能
不能
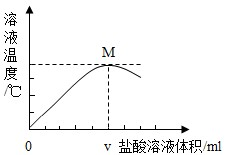
(填“能”或“不能”)说明样品中有NaOH.(3)如图是向净化后的氢氧化钠溶液中逐滴加入盐酸时溶液温度与盐酸溶液体积之间的变化关系图.图中M点的意义是
氢氧化钠和盐酸恰好完全反应
氢氧化钠和盐酸恰好完全反应
,此时反应中氢氧化钠和氯化氢的质量比是80:73
80:73
,氢氧化钠和盐酸的反应是放热
放热
反应(填“放热”或“吸热”).当所加盐酸的体积大于v mL时,溶液中存在的溶质是NaCl、HCl
NaCl、HCl
.(4)为从定量角度认识中和反应,小明同学自行设计并进行了下面实验:
①在小烧杯中倒入8%的氢氧化钠溶液l0g,滴入2滴酚酞试剂后,溶液呈红色;
②另取10%的稀盐酸逐滴滴加到氢氧化钠溶液中,边滴边振荡,随盐酸滴入,溶液颜色逐渐变浅;
③在溶液红色消失瞬间,停止实验.
若停止实验时,两溶液恰好反应.请分析小明实验后回答:实验中酚酞试剂的作用是
判断反应进行和进行的程度
判断反应进行和进行的程度
;计算出这时所得溶液的溶质质量分数是多少?(精确到0.1%)分析:[对固体猜想]根据氢氧化钠在保存期间可能吸收空气二氧化碳而全部变质为碳酸钠,也可能部分吸收二氧化碳而部分变质为碳酸钠,也可能因保存较为完善而未变质回答;
[实验和推断](1)根据碳酸钠与盐酸反应产生二氧化碳的性质回答.并写出反应的方程式;
(2)根据碳酸钠的性质及碳酸钠的碱性及反应的产物分析;
(3)根据酸碱中和反应伴随着放热现象,且二者恰好中和时放热最多分析M点的意义及恰好反应的质量比;当盐酸过量时除了有反应的产物外还有过量的酸;
(4)根据氢氧化钠和盐酸反应无现象,通过无色的酚酞试液可以间接帮助判断二者的反应及反应的程度;根据化学方程式计算出氯化钠和氯化氢的质量,再利用溶质的质量分数公式计算氯化钠的溶质质量分数.
[实验和推断](1)根据碳酸钠与盐酸反应产生二氧化碳的性质回答.并写出反应的方程式;
(2)根据碳酸钠的性质及碳酸钠的碱性及反应的产物分析;
(3)根据酸碱中和反应伴随着放热现象,且二者恰好中和时放热最多分析M点的意义及恰好反应的质量比;当盐酸过量时除了有反应的产物外还有过量的酸;
(4)根据氢氧化钠和盐酸反应无现象,通过无色的酚酞试液可以间接帮助判断二者的反应及反应的程度;根据化学方程式计算出氯化钠和氯化氢的质量,再利用溶质的质量分数公式计算氯化钠的溶质质量分数.
解答:解:[对固体猜想]氢氧化钠在保存期间可能吸收空气二氧化碳而全部变质为碳酸钠,也可能部分吸收二氧化碳而部分变质为碳酸钠,也可能因保存较为完善而未变质;
[实验和推断]碳酸钠与盐酸等酸反应产生二氧化碳有气泡产生,因此有气泡产生,说明氢氧化钠已经变质,反应的方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑(与所选的酸对应,合理均可);
(2)由于氢氧化钠与氢氧化钙不反应,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,所以滴加氢氧化钙溶液,有白色沉淀产生,说明含有碳酸钠;因为碳酸钠虽然属于盐,但显碱性也能使酚酞试液变红,且碳酸钠和氢氧化钙反应也产生氢氧化钠,再加入酚酞变红不能说明含有氢氧化钠;
(3)根据坐标氢氧化钠和盐酸反应放出热量,等二者恰好完全反应时,放出的热量最多,所以M点的意义是:氢氧化钠和盐酸恰好完全反应;根据氢氧化钠和盐酸反应的化学方程式意义计算可知:每40份质量的氢氧化钠和36.5份质量的盐酸恰好完全反应,因此反应中氢氧化钠和氯化氢的质量比是80:73;当所加盐酸的体积大于v mL时,说明盐酸过量.溶液中除了有反应生成的氯化钠外,还有过量的盐酸,因此溶液中存在的溶质是:NaCl、HCl;
(4)氢氧化钠和盐酸反应无现象,通过无色的酚酞试液的变色和褪色可以间接帮助判断二者的反应及反应的程度;
解:设共用去稀盐酸的质量为x,生成NaCl的质量为y
HCl+NaOH=NaCl+H2O
36.5 40 58.5
10% x 10g×8% y
=
x=7.3g
=
y=1.17g
NaCl%=
×100%=6.8%
答:所得溶液的溶质质量分数为6.8%.
故答案为:猜想Ⅰ:CO2+2NaOH=Na2CO3+H2O(或空气中的CO2与NaOH反应生成Na2CO3)
【实验和推断】(1)稀盐酸(或稀硫酸等)
Na2CO3+2HCl=2NaCl+H2O+CO2↑(与所选的酸对应,合理均可)
(2)CaCO3 不能
(3)氢氧化钠和盐酸恰好完全反应 80:73 放热 NaCl、HCl
(4)判断反应进行和进行的程度
解:设共用去稀盐酸的质量为x,生成NaCl的质量为y
HCl+NaOH=NaCl+H2O
36.5 40 58.5
10% x 10g×8% y
=
x=7.3g
=
y=1.17g
NaCl%=
×100%=6.8%
答:所得溶液的溶质质量分数为6.8%.
[实验和推断]碳酸钠与盐酸等酸反应产生二氧化碳有气泡产生,因此有气泡产生,说明氢氧化钠已经变质,反应的方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑(与所选的酸对应,合理均可);
(2)由于氢氧化钠与氢氧化钙不反应,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,所以滴加氢氧化钙溶液,有白色沉淀产生,说明含有碳酸钠;因为碳酸钠虽然属于盐,但显碱性也能使酚酞试液变红,且碳酸钠和氢氧化钙反应也产生氢氧化钠,再加入酚酞变红不能说明含有氢氧化钠;
(3)根据坐标氢氧化钠和盐酸反应放出热量,等二者恰好完全反应时,放出的热量最多,所以M点的意义是:氢氧化钠和盐酸恰好完全反应;根据氢氧化钠和盐酸反应的化学方程式意义计算可知:每40份质量的氢氧化钠和36.5份质量的盐酸恰好完全反应,因此反应中氢氧化钠和氯化氢的质量比是80:73;当所加盐酸的体积大于v mL时,说明盐酸过量.溶液中除了有反应生成的氯化钠外,还有过量的盐酸,因此溶液中存在的溶质是:NaCl、HCl;
(4)氢氧化钠和盐酸反应无现象,通过无色的酚酞试液的变色和褪色可以间接帮助判断二者的反应及反应的程度;
解:设共用去稀盐酸的质量为x,生成NaCl的质量为y
HCl+NaOH=NaCl+H2O
36.5 40 58.5
10% x 10g×8% y
| 36.5 |
| 10%x |
| 40 |
| 10g×8% |
| 40 |
| 10g×8% |
| 58.5 |
| y |
NaCl%=
| 1.17g |
| 10g+7.3g |
答:所得溶液的溶质质量分数为6.8%.
故答案为:猜想Ⅰ:CO2+2NaOH=Na2CO3+H2O(或空气中的CO2与NaOH反应生成Na2CO3)
【实验和推断】(1)稀盐酸(或稀硫酸等)
Na2CO3+2HCl=2NaCl+H2O+CO2↑(与所选的酸对应,合理均可)
(2)CaCO3 不能
(3)氢氧化钠和盐酸恰好完全反应 80:73 放热 NaCl、HCl
(4)判断反应进行和进行的程度
解:设共用去稀盐酸的质量为x,生成NaCl的质量为y
HCl+NaOH=NaCl+H2O
36.5 40 58.5
10% x 10g×8% y
| 36.5 |
| 10%x |
| 40 |
| 10g×8% |
| 40 |
| 10g×8% |
| 58.5 |
| y |
NaCl%=
| 1.17g |
| 10g+7.3g |
答:所得溶液的溶质质量分数为6.8%.
点评:本题考查了有关氢氧化钠变质及酸碱中和反应的问题,解答本类题的关键是要知道碳酸钠显碱性,也能使酚酞试液变红色,只有先把碳酸钠除掉才能再加入酚酞试液,验证是否含有氢氧化钠.

练习册系列答案
相关题目
