题目内容
【题目】根据下列实验装置示意图,回答问题。
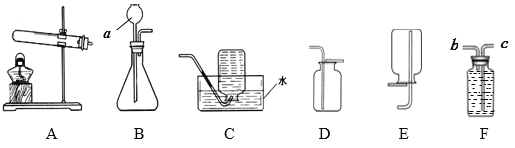
(1)仪器a的名称是______。
(2)实验室用氯酸钾和二氧化锰制取氧气可选用AC或AD组合,写出反应的化学方程式___________________; 若用F装置收集氧气,气体应从_____(填“b”或“c”)进入。
(3)实验室可用装置B制取多种气体。若用B与D组合制取气体,对应反应的化学方程式为____________________________。
【答案】 长颈漏斗 2KClO3 MnO2 2KCl + 3O2↑ b 2H2O2 MnO2 2H2O + O2 ↑ 或 CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
【解析】(1)根据常见仪器解答;
(2)氯酸钾在加入二氧化锰并加热的条件下生成氯化钾和氧气;
(3)B与D组合可以是过氧化氢在加入二氧化锰的条件下生成氧气和水;也可以是碳酸钙和稀盐酸反应生成氯化钙、水、二氧化碳。
解:(1)仪器a的名称是:长颈漏斗;
(2)氯酸钾在加入二氧化锰并加热的条件下生成氯化钾和氧气。化学方程式为:2KClO3 ![]() + 3O2↑;
+ 3O2↑;
(3)B与D组合可以是过氧化氢在加入二氧化锰的条件下生成氧气和水;也可以是碳酸钙和稀盐酸反应生成氯化钙、水、二氧化碳。化学方程式为:2H2O2 MnO2 2H2O + O2 ↑ 或 CaCO3 + 2HCl === CaCl2 + H2O + CO2↑。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】小明同学想在实验室用NaOH溶液与CO2气体制取Na2CO3溶液。但是经过检验,发现很难得到纯净的Na2CO3溶液,在老师的帮助下查阅了相关资料,制定了计划。
【查阅资料】
①CO2通入NaOH溶液时极易因CO2过量而产生NaHCO3,且无明显现象。
②NaHCO3溶液煮沸时不会发生分解反应;NaHCO3溶液与CaCl2溶液不反应
③NaHCO3+NaOH=Na2CO3+H2O
④Na2CO3+CaCl2=CaCO3↓+2NaCl
【制取步骤】
①量取两份50 mL相同浓度的NaOH溶液备用;
②用一份50 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
③小心煮沸②溶液1-2分钟;
④在得到的③的溶液中加入另一份50 mL NaOH溶液,使其充分混合即得。
【实验探究】制得的Na2CO3溶液中可能含有的杂质是___________。
为检验制得的溶液是否为纯净的Na2CO3溶液,请你与小明同学一起完成下列实验探究:
实验步骤 | 实验现象 | 实验结论 | |
取少量制得的溶液于试管中,加入过量的显中性的CaCl2溶液 | ________。 | 溶液中含有Na2CO3 | |
将上步实验所得混合物进行过滤,将滤液分成两份 | 取其中一份加入足量的____, | 无气泡产生 | 制得的溶液中不含_____, |
取另一份加入______, |
| 制得的溶液中含NaOH | |
【结论】所制得的不是纯净的Na2CO3溶液。
【评价与反思】小芳同学认为可以用过量的Ca(OH)2溶液替代CaCl2溶液进行以上实验,你认为是否可行,并说明原因_______________。