��Ŀ����
����Ŀ���Ѿ���Ӳ�ȴ��ܶ�С���۵�ߡ�����ʴ�Ե��������ܣ�����Ϊ��δ����������������ʯ����Ҫ�ɷ�����������(FeTiO3)��ұ��������ʱ����Ҫ��������������Ӧ��
��2FeTiO3��6C��7Cl2![]() 2X��2TiCl4��6CO ��TiCl4��2Mg
2X��2TiCl4��6CO ��TiCl4��2Mg![]() Ti��2MgCl2
Ti��2MgCl2
�����й�˵����ȷ����
A������������Ti�ԣ�3��
B����Ӧ��������������н��У��������������
C����ʽ����X���Ļ�ѧʽΪFeCl2
D����������������Ӧ���õ��Ѽ�Ϊ������
���𰸡�D
�����������ݡ��ڻ������У��������ϼ۵Ĵ�����Ϊ�㡱��ԭ����֪Fe�Ļ��ϼ�Ϊ+2�ۣ�O�Ļ��ϼ�Ϊ-2�ۣ�Ti�Ļ��ϼ�Ϊx����(+2)+x+ (-2)��3=0��x=+4��A�����������غ㶨�ɻ�ѧ��Ӧǰ��ԭ�ӵ��������Ŀ���䣬��ӦǰFe��2 ��Ti��2�� O��6 ��C��6�� Cl��14 ����Ӧ��Fe��0 ��Ti��2��O��6��C��6��Cl��8 ��x��ǰ����ϵ��2����X�Ļ�ѧʽΪFeCl3��B����Ӧ��������������н��У������������������C����.����������һ��������ɵģ���ѡD.
������������ݸ��ݻ�������Ԫ�ػ��ϼ۵Ĵ�����Ϊ0�������Ԫ�ء���Ԫ�صĻ��ϼۼ���ѧʽ������Ԫ�صĻ��ϼ۷��������ݴ����ĸ�������÷��������������غ㶨�ɣ���ѧ��Ӧǰ��ԭ�Ӹ�����������䣬�ҳ�����ʽ����ԭ�ӵĸ������X�ķ��ӹ��ɣ�ȷ���仯ѧʽ�����ݴ���������һ��������ɷ���.

����Ŀ����5�֣��ڡ������غ㶨�ɡ��Ŀ��ý�ѧ�У��ס�������ͬѧ�����ˡ���ѧ��Ӧ�У���Ӧ�����������������ϵ����ʵ��̽����ʵ��װ�ú�ѡ��ҩƷ��ͼ��ʾ��
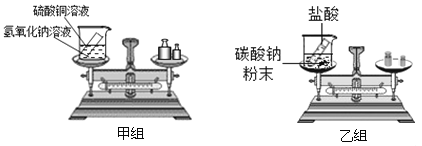
����ʾ��CuSO4+2NaOH==Na2SO4+Cu(OH)2����2HCl+Na2CO3==2NaCl+H2O+CO2����
��1������ʵ��Ŀ�ģ�����ͬѧӦ�ò�����������_____________���ֻ�з�Ӧǰ����ֻ�з�Ӧ����Ӧǰ����֮һ��������Ӧװ�D�������ձ����Թܺ�ҩƷ����������
��2��ʵ����������Ƕ������˹淶�IJ�����ȷ�ij�����ϸ�µĹ۲죺
���� | ���� | |
���� | ������ɫ��������ƽƽ�� | �����غ� |
���� | ���ִ������ݣ���ƽ��ƽ�� | �������غ� |
����ʵ�鷴Ӧ����ƽ��ƽ�⣬��ƽָ���� ƫת������ҡ���������Ϊ������ȷ���� ������顱�����顱������������һ�����۴����ԭ���� ��
��3���������غ㶨�ɿ�֪����ѧ��Ӧǰ��һ��������� ��������ţ�
��ԭ������ ��ԭ����Ŀ ���������� ��������Ŀ ��Ԫ������ ����������
