题目内容
取相对分子质量为46的某有机物4.6g,在足量的氧气中充分燃烧,生成8.8g二氧化碳和5.4g水,据此判断该有机物一定含有________元素,其分子中各元素的原子个数比为________.
碳、氢、氧 2:6:1
分析:根据可燃物燃烧的规律,生成的8.8g二氧化碳中所含碳元素质量和5.4g水中所含氢元素的质量均来自4.6g有机物,通过有机物质量与碳、氢元素的质量和的对比,可确定有机物中是否含氧元素,最后利用元素质量与元素的相对原子质量,求得有机物中组成元素的原子个数比.
解答:根据质量守恒定律可知,一种物质燃烧只生成水和二氧化碳,则该物质肯定含有碳和氢元素,是否含氧则通过计算确定确定:
8.8g二氧化碳中所含碳元素质量=8.8g×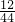 ×100%=2.4g,5.4g水中所含氢元素的质量=5.4g×
×100%=2.4g,5.4g水中所含氢元素的质量=5.4g×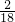 ×100%=0.6g;
×100%=0.6g;
有机物中碳、氢元素的质量和=2.4g+0.6g=3.0g,小于有机物的质量4.6g,因此有机物中含氧元素,其中氧元素的质量=4.6g-3.0g=1.6g
该有机物中碳、氢、氧各元素原子的个数比= :
: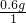 :
: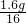 =2:6:1
=2:6:1
故答案为:碳、氢、氧;2:6:1.
点评:根据组成元素质量比为各元素的相对原子质量与原子个数乘积的比,因此原子个数比为组成元素质量与相对原子质量的比.
分析:根据可燃物燃烧的规律,生成的8.8g二氧化碳中所含碳元素质量和5.4g水中所含氢元素的质量均来自4.6g有机物,通过有机物质量与碳、氢元素的质量和的对比,可确定有机物中是否含氧元素,最后利用元素质量与元素的相对原子质量,求得有机物中组成元素的原子个数比.
解答:根据质量守恒定律可知,一种物质燃烧只生成水和二氧化碳,则该物质肯定含有碳和氢元素,是否含氧则通过计算确定确定:
8.8g二氧化碳中所含碳元素质量=8.8g×
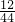 ×100%=2.4g,5.4g水中所含氢元素的质量=5.4g×
×100%=2.4g,5.4g水中所含氢元素的质量=5.4g×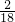 ×100%=0.6g;
×100%=0.6g;有机物中碳、氢元素的质量和=2.4g+0.6g=3.0g,小于有机物的质量4.6g,因此有机物中含氧元素,其中氧元素的质量=4.6g-3.0g=1.6g
该有机物中碳、氢、氧各元素原子的个数比=
 :
: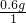 :
: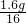 =2:6:1
=2:6:1故答案为:碳、氢、氧;2:6:1.
点评:根据组成元素质量比为各元素的相对原子质量与原子个数乘积的比,因此原子个数比为组成元素质量与相对原子质量的比.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
 某化合物A(其相对分子质量为46)由C、H、O三种元素组成,其中碳元素、氢元素、氧元素的质量分数分别为52%、13%、35%,试通过计算写出化合物A的化学式.
某化合物A(其相对分子质量为46)由C、H、O三种元素组成,其中碳元素、氢元素、氧元素的质量分数分别为52%、13%、35%,试通过计算写出化合物A的化学式.
