题目内容
【题目】追随科学家的足迹,溯源求真。燃素说——可燃物中含有气态“燃素”,燃烧时被释放出,则物质燃烧后质量减轻。
(1)请举例说明“燃素说”是错误的:_____。
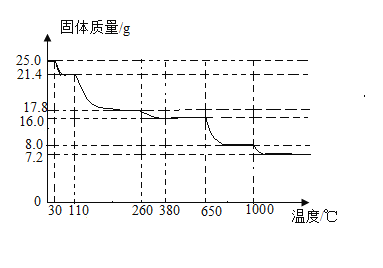
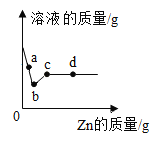
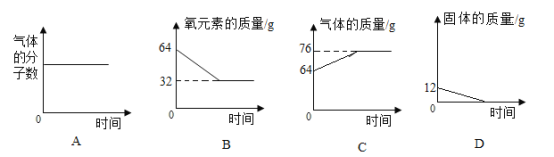
(2)在一密闭的容器中,12 g炭粉与64 g氧气点燃后充分反应,容器内各相关量与时间(从反应开始计时)的对应关系如下图所示,其中正确的有_____(填标号)。
【答案】铁丝在氧气中燃烧,四氧化三铁的质量大于铁丝的质量 ACD
【解析】
(1)红磷在氧气中燃烧,生成的五氧化二磷的质量大于红磷的质量或铁丝在氧气中燃烧,生成的四氧化三铁的质量大于铁的质量,故“燃素说”是错误的;
(2)A、炭粉与氧气点燃后充分反应的化学方程式为: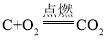 ,气体的分子数不变,符合题意;
,气体的分子数不变,符合题意;
B、根据质量守恒定律,化学反应前后,元素的种类、数目、质量不变,故B图错误,不符合题意;
C、根据质量守恒定律,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,故生成物二氧化碳气体的质量应是参加反应的碳的质量加上参加反应的氧气的质量,原先的气体为氧气,质量为64g,在化学反应过程中,气体的质量逐渐增加,反应完全后,二氧化碳质量和剩余氧气的质量为76g,质量不再变化,符合题意;
D、该化学反应中,固体的质量为炭粉的质量为12g,随着反应的进行,炭粉和氧气反应逐渐生成二氧化碳,固体质量逐渐减少至零,符合题意。
故选ACD。

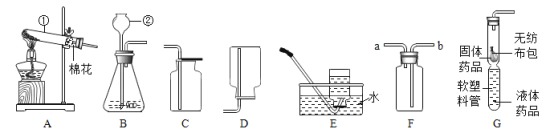
【题目】某研究小组用下图所示装置,探究能否用镁条代替红磷测定空气中氧气含量。

(提出猜想)
猜想1:可以代替,因为镁条与氧气反应后不会产生气体
猜想2:不能代替,因为镁条可能会与空气中的其他成分发生反应
(进行实验)
步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装好装置后,打开止水夹,手捂集气瓶,一段时间后,松开手 | 烧杯中导管口有气泡冒出,松手后,烧杯中导管末端有一段液柱 |
Ⅱ | 关闭止水夹,点燃镁条,迅速伸入集气瓶中,塞好塞子 | 镁条燃烧,放出大量热,发出耀眼白光,生成大量白烟,剩余固体为白色带状物还夹杂着极少量淡黄色的固体。 |
Ⅲ | 冷却至室温,打开止水夹 | 烧杯中水从导管进入集气瓶中,体积约为集气瓶体积的2/5 |
(解释与结论)
(1)镁条与氧气反应的化学方程式为_____。
(2)步骤Ⅰ说明装置的气密性_____。
(3)步骤Ⅱ中,关闭止水夹的目的是_____。
(4)根据实验现象中的_____(写一个)可以推测猜想2成立。
(继续探究)经查阅资料得知氮化镁(Mg3N2)为淡黄色的固体。
(设计实验)设计实验证明镁与氮气发生了反应:_____。
(实验结论)镁条与氮气反应的化学方程式为:_____。
(反思与评价)通过上述探究活动,你对燃烧有什么新的认识?_____。