题目内容
a.张化验员对本炼铁厂进购的赤铁矿(主要成分三氧化二铁)样品进行分析,取10.0g的样品,完全反应后,共用去稀盐酸103.0g,过滤后得到2.5g滤渣,(假设杂质既不溶于酸,也不溶于水;不考虑实验中的损耗).求(计算结果保留一位小数):
(1)赤铁矿样品中Fe2O3的质量分数为多少?
(2)稀盐酸中溶质的质量分数为多少?
b.过氧化氢的水溶液俗称双氧水,在放置过程中会缓慢分解.现有一瓶未曾使用过的、久置的双氧水,瓶上商品标签提供了如下信息:
①H2O2的质量分数为30%;
②内装溶液质量1000g;
③实验测定,其中H2O2的质量分数仅为10%.
(1)若用这瓶双氧水来配制H2O2的质量分数为3%的医用双氧水1500g,需用这种双氧水的质量是多少?
(2)计算这瓶双氧水中已分解的过氧化氢的质量.(计算结果保留整数)我解答______小题(请在横线上填写题号“a”或“b”,以确认你的选择).
a、解:(1)赤铁矿样品中Fe2O3的质量10.0g-2.5g=7.5g
赤铁矿样品中Fe2O3的质量分数=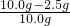 ×100%=75%;
×100%=75%;
(2)设HCl的质量为x
Fe2O3+6HCl=2FeCl3+3H2O
160 219
7.5g x
160:219=7.5g:x 解之得 x≈10.3g
稀盐酸中溶质的质量分数=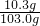 ×100%=10%
×100%=10%
答:(1)赤铁矿样品中Fe2O3的质量分数为75%;
(2)稀盐酸中溶质的质量分数为10%.
b、解:(1)设需用这种双氧水的质量为x
1500g×3%=x×10%
解之得 x=450g
(2)30%过氧化氢溶液中溶剂水的质量=1000g-1000g×30%=700g
10%过氧化氢溶液的质量=700g÷(1-10%)≈777.8g
则这瓶双氧水中已分解的过氧化氢的质量=1000g-777.8g≈222g
答:(1)需用这种双氧水的质量是450g;
(2)这瓶双氧水中已分解的过氧化氢的质量约为222g.
分析:a.据题意,赤铁矿中氧化铁全部发生反应而杂质不与酸反应也不溶于水,因此过滤后得到2.5g滤渣即是赤铁矿中的杂质,据此可计算出赤铁矿中发生反应的氧化铁的质量,然后根据氧化铁质量解决问题;
b.所实验测定结果,该瓶未曾使用过的、久置的双氧水,在放置过程中一部分已经分解,现在该溶液的质量分数仅为10%.因此在使用该溶液配制3%的溶液时要注意这一点;分解前后溶液的质量差即为已分解的过氧化氢的质量,根据前后溶剂水的质量不变求出10%的溶液质量.
点评:注意:分解后10%的过氧化氢溶液的溶质质量=1000g×10%,是错误的计算,原因是分解后10%溶液质量不是1000g.
赤铁矿样品中Fe2O3的质量分数=
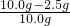 ×100%=75%;
×100%=75%;(2)设HCl的质量为x
Fe2O3+6HCl=2FeCl3+3H2O
160 219
7.5g x
160:219=7.5g:x 解之得 x≈10.3g
稀盐酸中溶质的质量分数=
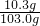 ×100%=10%
×100%=10%答:(1)赤铁矿样品中Fe2O3的质量分数为75%;
(2)稀盐酸中溶质的质量分数为10%.
b、解:(1)设需用这种双氧水的质量为x
1500g×3%=x×10%
解之得 x=450g
(2)30%过氧化氢溶液中溶剂水的质量=1000g-1000g×30%=700g
10%过氧化氢溶液的质量=700g÷(1-10%)≈777.8g
则这瓶双氧水中已分解的过氧化氢的质量=1000g-777.8g≈222g
答:(1)需用这种双氧水的质量是450g;
(2)这瓶双氧水中已分解的过氧化氢的质量约为222g.
分析:a.据题意,赤铁矿中氧化铁全部发生反应而杂质不与酸反应也不溶于水,因此过滤后得到2.5g滤渣即是赤铁矿中的杂质,据此可计算出赤铁矿中发生反应的氧化铁的质量,然后根据氧化铁质量解决问题;
b.所实验测定结果,该瓶未曾使用过的、久置的双氧水,在放置过程中一部分已经分解,现在该溶液的质量分数仅为10%.因此在使用该溶液配制3%的溶液时要注意这一点;分解前后溶液的质量差即为已分解的过氧化氢的质量,根据前后溶剂水的质量不变求出10%的溶液质量.
点评:注意:分解后10%的过氧化氢溶液的溶质质量=1000g×10%,是错误的计算,原因是分解后10%溶液质量不是1000g.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目