题目内容
 (2007?丰台区一模)化学小组的同学在学习了酸碱中和反应后,设计了一个能观察到明显现象的实验,说明氢氧化钠溶液与稀盐酸确实发生了反应.请帮助他们填写下列实验报告.
(2007?丰台区一模)化学小组的同学在学习了酸碱中和反应后,设计了一个能观察到明显现象的实验,说明氢氧化钠溶液与稀盐酸确实发生了反应.请帮助他们填写下列实验报告.| 实验步骤 | 实验现象 | 实验结论 |
分析:根据酚酞试液遇碱性溶液变红以及遇中性或酸性溶液不变色,借助酚酞试液从而判断氢氧化钠溶液与稀盐酸确实发生了反应;碳酸钠溶液和氯化钙溶液反应生成碳酸钙白色沉淀,由沉淀的质量求出碳酸钠的质量,进而求出氢氧化钠的质量即可进行解答.
解答:解:酚酞试液遇碱性溶液变红,而遇中性或酸性溶液不变色,借助酚酞试液从而判断氢氧化钠溶液与稀盐酸确实发生了反应.
故答案为:
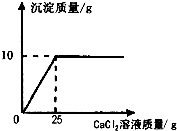
设样品中碳酸钠的质量为x.由图可知碳酸钙的质量为10g.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10g
=
x=10.6g
该样品中氢氧化钠的质量分数=
×100%=27.4%
答:该样品中氢氧化钠的质量分数为27.4%.
故答案为:
| 实验步骤 | 实验现象 | 实验结论 |
| 1、取少量氢氧化钠溶液于小烧杯中,滴加几滴无色的酚酞试液 2、向上述溶液中逐滴加入稀盐酸,并振荡 |
1、溶液变红色 2、溶液由红色变为无色 |
1、碱溶液能使酚酞试液变红 2、氢氧化钠溶液与稀盐酸确实发生了反应 |
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10g
| 106 |
| x |
| 100 |
| 10g |
x=10.6g
该样品中氢氧化钠的质量分数=
| 14.6g-10.6g |
| 14.6g |
答:该样品中氢氧化钠的质量分数为27.4%.
点评:本题考查了酸碱中和反应以及物质的性质,完成此题,可以依据已有的知识进行,要求同学们加强对基础知识的储备,以便灵活应用.

练习册系列答案
相关题目
