题目内容
将10g不纯的氯化镁样品(杂质不溶于水),放入50g水中,充分搅拌,待样品中的氯化镁全部溶解后过滤(滤液损失不计).将所得滤液与63.3g氢氧化钠溶液恰好完全反应,生成5.8g白色沉淀.求:(1)样品中氯化镁的质量分数.
(2)反应后所得溶液的质量.
【答案】分析:(1)白色沉淀是氢氧化镁的质量,根据氢氧化镁的质量计算出氯化镁的质量,再用氯化镁的质量除以10g,乘以百分之百即可;(2)反应后溶液的质量等于氯化镁的质量+水的质量+氢氧化钠的质量-沉淀的质量.
解答:解:设要生成5.8g氢氧化镁质量需要参加反应的氯化镁的质量为X,则:
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 58
x 5.8g
(1)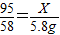 解得x=9.5g
解得x=9.5g
MgCl2%= =95%
=95%
(2)m(NaCl溶液)=9.5g+50g+63.3g-5.8g=117g.
故答案为:(1)95%;(2)117g.
点评:解答本题容易出错的地方是计算反应后溶液质量时,容易把杂质的质量加上,还容易忘掉减去沉淀的质量.
解答:解:设要生成5.8g氢氧化镁质量需要参加反应的氯化镁的质量为X,则:
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 58
x 5.8g
(1)
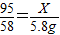 解得x=9.5g
解得x=9.5g MgCl2%=
 =95%
=95% (2)m(NaCl溶液)=9.5g+50g+63.3g-5.8g=117g.
故答案为:(1)95%;(2)117g.
点评:解答本题容易出错的地方是计算反应后溶液质量时,容易把杂质的质量加上,还容易忘掉减去沉淀的质量.

练习册系列答案
相关题目