题目内容
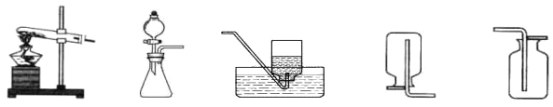
【题目】小明同学欲通过化学实验证明“质量守恒定律”,确定以“稀盐酸与碳酸钙反应”为研究对象,设计的实验装置如图所示。

(1)根据实验目的,小明应该测量的数据是 (填“只有反应前”“只有反应后”“反应前、后”)整个反应装置(包括锥形瓶、气球和药品)的质量。
(2)实验步骤如下:
①按如图方式放好仪器,使天平平衡,记录称量数据。
②将碳酸钙粉末全部倒入锥形瓶中,观察到锥形瓶中出现的现象是 ,反应的化学方程式 。
③当反应结束时,气球已经完全鼓起,小明发现天平的指针已经向右偏。小明又重新称量,记录了数据。
(3)他感到困惑:其他操作均正常,实验现象与数据为何与预测结果不符?你认为出现该实验现象的合理解释应该是下列各项中的 (填序号)。
A、该反应前后原子的种类、数目变少
B、该反应生成物的总质量小于反应物的总质量
C、空气的浮力作用干扰了实验结果
D、生成气体的反应不遵守质量守恒定律
【答案】反应前、后 有气泡产生 CaCO3+2HCl=CaCl2+H2O+CO2↑ C
【解析】
试题分析:质量守恒定律即为反应前后参与反应的物质的总质量=生成的物质的总质量。(1)因此要称量反应前后的质量进行对比;(2)②CaCO3+2HCl===CaCl2+H2O+CO2↑,生成气体,因此有气泡;(3)生成的气体体积大,质量不变因此物质的密度减小,受到的空气浮力更大,称量得到的重量减小,因此选C;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】能源、环境问题是保证我国可持续发展的关键,请回答下列问题:
(1)现在,我国还是以化石燃料为主要能源获得能量,常见的化石燃料包括煤、 和天然气等.它们属于 再生能源(填“可”或“不可”).
(2)化学反应也可用来获得能量,下列反应过程中会放出热量的是 (填答案序号)
A.生石灰与水 B.碳与二氧化碳 C.镁与盐酸
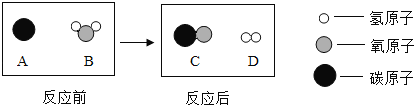
(3)为减少环境污染、提高煤的利用率,可将其转化为可燃性气体,此过程可认为是碳与水的反应,其微观示意图如图所示:该反应的化学方程式为 ,基本反应类型为 .
(4)为了减少环境污染和温室气体,人们努力减少对化石燃料的依赖.经研究发现NH3燃烧的产物也没有污染,且释放大量能量,作为燃料它在某些方面还优于H2.
①将NH3燃烧反应的化学方程式补充完整:4NH3+3O2![]() 6H2O+ .
6H2O+ .
②请根据下表信息分析用NH3取代H2的优点:
颜色、气味 | 熔点(℃) | 沸点(℃) | 常温时,1L水中能溶解的气体体积 | 标况下密度 (g/L) | |
NH3 | 无色、刺激性 | ﹣77.7 | ﹣33 | 700L | 0.6942 |
H2 | 无色、无味 | ﹣259.2 | ﹣253 | 0.017L | 0.0899 |
由于NH3比H2沸点高,所以更易 ,便于储存和运输.NH3泄漏时易发现是因为 ,同时它易溶于水,便于处理.