题目内容
下列实验过程与图象描述相符合的一组是( )
分析:A、氢氧化钙的溶解度随温度的升高而减小;
B、根据金属和盐反应的方程式,利用差量法进行分析;
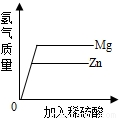
C、等质量的金属与足量的酸反应,则金属全部参加反应,生成氢气的质量等于
产生氢气的速率与金属的活动性有关;
D、根据酸碱的PH范围判断.
B、根据金属和盐反应的方程式,利用差量法进行分析;
C、等质量的金属与足量的酸反应,则金属全部参加反应,生成氢气的质量等于
| 金属的质量×金属的化合价 |
| 金属的相对原子质量 |
D、根据酸碱的PH范围判断.
解答:解:A、氢氧化钙的溶解度随温度的升高而减小,而不是逐渐增大,故错误;
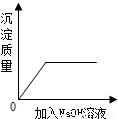
B、铁与硝酸银反应生成银和硝酸亚铁,方程式是:Fe+2AgNO3═2Ag+Fe(NO3)2固体质量△m
56 216 216-56=160
由此可知,随着反应的进行,固体质量逐渐增加,则溶液质量逐渐减小,当铁片反应完,则质量不再变化,坐标图正确;
C、等质量Mg、Zn加入足量的稀盐酸,镁反应的速率大于锌,表现在坐标中斜线较陡,等质量的金属与足量的酸反应,则金属全部参加反应,生成氢气的质量等于
,镁和锌都是+2价,金属的质量相等,镁的相对原子质量小于锌的相对原子质量,则镁生成的氢气质量大于锌生成的氢气的质量,故正确;
D、该反应是中和反应,横坐标是盐酸的体积,则是将盐酸滴加到碱液中,则溶液的起始pH>7,而非小于7,故错误;
故选BC.
B、铁与硝酸银反应生成银和硝酸亚铁,方程式是:Fe+2AgNO3═2Ag+Fe(NO3)2固体质量△m
56 216 216-56=160
由此可知,随着反应的进行,固体质量逐渐增加,则溶液质量逐渐减小,当铁片反应完,则质量不再变化,坐标图正确;
C、等质量Mg、Zn加入足量的稀盐酸,镁反应的速率大于锌,表现在坐标中斜线较陡,等质量的金属与足量的酸反应,则金属全部参加反应,生成氢气的质量等于
| 金属的质量×金属的化合价 |
| 金属的相对原子质量 |
D、该反应是中和反应,横坐标是盐酸的体积,则是将盐酸滴加到碱液中,则溶液的起始pH>7,而非小于7,故错误;
故选BC.
点评:此题是对化学反应及图象的考查,解题的重点是能正确的分析变化的过程,读懂图象并与反应相结合是解题的关键所在,是一道训练学生分析问题能力很好的习题.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目