题目内容
一定质量10%的A溶液和一定质量10%的NaOH溶液恰好完全反应,生成蓝色沉淀B,过滤,干燥后称重B为9.8g,化学方程式为A+2NaOH=B↓+Na2SO4(已配平)
(1)A和B的相对分子质量之差为______
(2)求滤出B后所得溶液中Na2SO4的质量分数.(计算结果保留一位小数)
解:(1)由于B是蓝色沉淀,所以B是氢氧化铜,依据复分解反应的反应特点可知A是硫酸铜,所以该反应的方程式为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,所以A和B的相对分子质量之差为(1)(64+32+16×4)-[64+(1+16)×2]=62
(2)设:生成硫酸钠质量为x,硫酸铜溶液的质量为y,氢氧化钠溶液质量为z.
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 80 98 142
10%y 10%z 9.8g x

x=14.2g y=160g z=80g
硫酸钠的质量分数: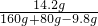 ×100%=6.2%
×100%=6.2%
故答案为:(1)62;(2)答:滤出B后所得溶液中Na2SO4的质量分数6.2%
分析:(1)依据B是蓝色沉淀,所以B是氢氧化铜,根据复分解反应的规律可知A的化学式,从而利用化学式的有关计算可求出A和B的相对分子质量之差;
(2)根据生成的沉淀质量利用相关的化学方程式进行计算,即可求出A的质量、氢氧化钠的质量和生成的硫酸钠的质量,进而可计算硫酸钠的质量分数;
点评:本题主要考查学生根据化学方程式找出已知量和未知量的关系列比例式求解问题的能力及溶质质量分数的计算问题.根据化学方程式的计算,就是依据反应物和生成物间的质量比进行的;已知反应物的质量可以算出生成物的质量,反之,已知生成物的质量也可以算出所需反应物的质量.
(2)设:生成硫酸钠质量为x,硫酸铜溶液的质量为y,氢氧化钠溶液质量为z.
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 80 98 142
10%y 10%z 9.8g x

x=14.2g y=160g z=80g
硫酸钠的质量分数:
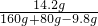 ×100%=6.2%
×100%=6.2%故答案为:(1)62;(2)答:滤出B后所得溶液中Na2SO4的质量分数6.2%
分析:(1)依据B是蓝色沉淀,所以B是氢氧化铜,根据复分解反应的规律可知A的化学式,从而利用化学式的有关计算可求出A和B的相对分子质量之差;
(2)根据生成的沉淀质量利用相关的化学方程式进行计算,即可求出A的质量、氢氧化钠的质量和生成的硫酸钠的质量,进而可计算硫酸钠的质量分数;
点评:本题主要考查学生根据化学方程式找出已知量和未知量的关系列比例式求解问题的能力及溶质质量分数的计算问题.根据化学方程式的计算,就是依据反应物和生成物间的质量比进行的;已知反应物的质量可以算出生成物的质量,反之,已知生成物的质量也可以算出所需反应物的质量.

练习册系列答案
相关题目
(11分)氯化镁是制取镁的原料之一。现要测定某化工产品(含MgCl2和KCl)中所含的氯化镁质量分数,进行实验:先将10g样品完全溶于水,然后把50g一定质量分数的氢氧化钾溶液平均分五次加入样品溶液中,充分振荡,实验所得数据见下表:
|
编号 |
1 |
2 |
3 |
4 |
5 |
|
加入氢氧化钾溶液的质量/g |
10 |
10 |
10 |
10 |
10 |
|
生成沉淀的质量/g |
0.58 |
a |
1.74 |
2.32 |
2.32 |
请分析上述数据,回答下列问题:
(1)表中a为______。(2分)
(2)样品中的氯化钾属于化肥中的______肥。(2分)
(3)所用的氢氧化钾溶液中溶质的质量分数是______。(2分)
(4)计算样品中氯化镁的质量分数是多少?(写出计算过程)