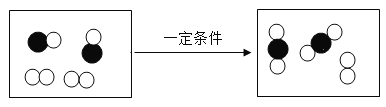
题目内容
请根据下列图示装置回答问题。
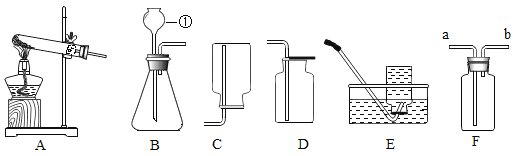
(1)仪器①的名称是__________________。
(2)实验室用高锰酸钾制取和收集较纯净的氧气,选用的组合装置是_________________(填字母);写出实验室用大理石和稀盐酸制取二氧化碳的化学方程式:__________________。
(3)选用D装置收集氧气的理由是__________________。
(4)氨气是一种有刺激性气味、密度比空气小、极易溶于水的气体,如果用F装置收集氨气,气体应从______(填“a”或“b”)端通入;为防止多余的氨气逸散到空气中,可用____________(填写物质名称)吸收。
我国某科研团队以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料,制取高纯碳酸锰,工艺流程如下图:
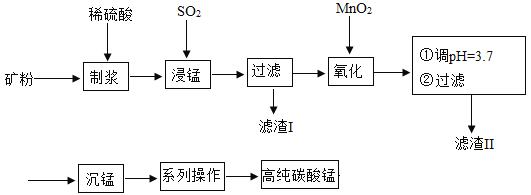
已知:①SiO2不溶于水,不与稀H2SO4、SO2反应;②MnO2能将Fe2+氧化成Fe3+;③溶液中的Fe3+在 pH 大于或等于 3.2 时将完全转化为Fe(OH)3沉淀。
请回答:(1)滤渣Ⅰ、Ⅱ分别为_____、_____(写化学式) ;
(2)浸锰过程中发生了 2 个化学反应,其中一个为Fe2O3与SO2反应,该反应的化学方 程式为Fe2O3+ SO2+H2SO4=2FeSO4+ H2O,另一个为MnO2和SO2按化学计量数为 1:1 发生化合反应,请写出该反应的化学方程式:_____, 该反应中共有_____种元素的化合价发生了改变。
(3)“沉锰”:加入NH4HCO3溶液后,生成了 4 种产物,其中含有MnCO3沉淀和某种气 体,写出该反应的化学方程式:_____。
(4)取所得的高纯MnCO311.7g溶于足量的盐酸中,将产生的气体用足量的Ba(OH)2浓 溶液吸收,得到白色沉淀 19.7g,则所得产品的纯度为_____%(保留一位小数)
(5)某研究小组用稀H2SO4与菱锰矿(含有MnCO3)反应来浸出Mn2+,该研究小组选 定两个因素作为研究条件进行对比实验,数据如下:
矿酸比 | 温度/(℃) | 浸出率/(%) | |
1 | 1:0.5 | 60 | 80.2 |
2 | 1:0.5 | 80 | 83.8 |
3 | 1:0.6 | 60 | X |
4 | 1:0.6 | 80 | 91.8 |
表中 X 最有可能的数值为_____。
a.79.7 b.80.8 c.87.6 d.92.8



 ”和“
”和“ ”分别表示不同元素的原子),有关说法错误的是
”分别表示不同元素的原子),有关说法错误的是