题目内容
某化合物在氧气中完全燃烧时,消耗了氧气4.8克,同时只生成4.4克的二氧化碳和2.7克水,则该化合物的质量为_________克,此化合物所含元素为________________(填:元素符号)各元素的质量比为_________________(与所填元素对应)
2.3 C H O 12 :3 :8
试题分析:根据质量守恒定律,该化合物的质量为
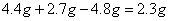 ;根据质量守恒定律,该化合物中一定含有碳元素和氢元素,4.4克的二氧化碳中含有的氧元素质量为3.2g,2.7g水中含氧元素质量为2.4g,二氧化碳中含有的氧元素的质量和水中含有的氧元素质量之和为5.6g,大于消耗的氧气质量,说明此化合物中含有氧元素,此外各元素的质量比为1.2g:0.3g:(3.2g+2.4g-4.8g)=12 :3 :8。
;根据质量守恒定律,该化合物中一定含有碳元素和氢元素,4.4克的二氧化碳中含有的氧元素质量为3.2g,2.7g水中含氧元素质量为2.4g,二氧化碳中含有的氧元素的质量和水中含有的氧元素质量之和为5.6g,大于消耗的氧气质量,说明此化合物中含有氧元素,此外各元素的质量比为1.2g:0.3g:(3.2g+2.4g-4.8g)=12 :3 :8。点评:此题是关于质量守恒定律的应用方面的题目,属于中考的热点题目,可在选择题、填空题中出现,考查形式较为灵活,注意仔细审题。

练习册系列答案
相关题目
