题目内容
(2009?常州)为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉未于质量为51.8克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入80g稀硫酸时反应恰好完全,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图.试通过计完成下列填空:(不能整除时,结果保留一位小数)
(1)该实验取用的样品质量为:______;
(2)样品中铁的质量分数为:______;
(3)小王不慎在反应结束后,向烧杯中多了20g稀硫酸,此时,溶液中亚铁离子在溶液总质量中的质量分数为:______,若在上图中补绘此过程中稀硫酸的质量与烧杯及烧杯内物质的总质量的关系图,所得线段的终点位于线段AB延长线的_______(填:上方、下方或线上).

【答案】分析:(1)实验开始时烧杯及烧杯内物质碳素钢样品的总质量为68.8g,因此,总质量减去烧杯的质量即为取用的样品质量;
(2)利用质量守恒定律可计算出铁与硫酸恰好完全反应时放出氢气的质量,由反应产生氢气的质量,根据反应的化学方程式,计算参加反应的铁的质量,所计算的铁的质量与所取样品质量比即为样品中铁的质量分数;
(3)反应后溶液为硫酸亚铁,溶液中亚铁离子的质量即硫酸亚铁中铁元素的质量;硫酸亚铁中铁元素全部来自于与硫酸反应的铁,因此,硫酸亚铁中铁元素质量即参加反应的铁的质量;多加了20g稀硫酸后,根据质量守恒定律计算此时溶液的质量,然后利用溶液的溶质质量分数计算公式计算出溶液中亚铁离子在溶液总质量中的质量分数;
多加的硫酸没发生反应而溶液质量直接增加,而此前溶液增加量为所加稀硫酸质量与放出氢气质量的差,因此,补绘的线段的终点高于原线段的沿长线.
解答:解:(1)该实验取用的样品质量=68.8g-51.8g=17g
故答案为:17g;
(2)根据质量守恒定律,恰好完全反应时放出氢气的质量=80g+68.8g-148.2g=0.6g,设参加反应铁的质量为x,则
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.6g
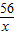 =
=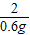 x=16.8g
x=16.8g
样品中铁的质量分数=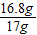 ×100%≈98.8%
×100%≈98.8%
故答案为:98.8%;
(3)溶液中亚铁离子在溶液总质量中的质量分数=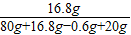 ×100%≈14.5%;
×100%≈14.5%;
加入80g稀硫酸恰好完全反应前,溶液质量增加值为加入稀硫酸质量与放出氢气的质量差,而多加入的20g稀硫酸不再发生反应,溶液增加量即所加入稀硫酸的质量;由于多加入20g稀硫酸时溶液增加量大于恰好完全反应前的溶液增加量,所以,补绘此过程中稀硫酸的质量与烧杯及烧杯内物质的总质量的关系图,所得线段的终点位于线段AB延长线的上方;
故答案为:14.5%;上方.
点评:根据质量守恒定律,恰好完全反应时放出氢气的质量=恰好完全反应时所加稀硫酸的质量+实验开始时烧杯及烧杯内样品的质量-恰好完全反应时烧杯与烧杯内物质的质量.
(2)利用质量守恒定律可计算出铁与硫酸恰好完全反应时放出氢气的质量,由反应产生氢气的质量,根据反应的化学方程式,计算参加反应的铁的质量,所计算的铁的质量与所取样品质量比即为样品中铁的质量分数;
(3)反应后溶液为硫酸亚铁,溶液中亚铁离子的质量即硫酸亚铁中铁元素的质量;硫酸亚铁中铁元素全部来自于与硫酸反应的铁,因此,硫酸亚铁中铁元素质量即参加反应的铁的质量;多加了20g稀硫酸后,根据质量守恒定律计算此时溶液的质量,然后利用溶液的溶质质量分数计算公式计算出溶液中亚铁离子在溶液总质量中的质量分数;
多加的硫酸没发生反应而溶液质量直接增加,而此前溶液增加量为所加稀硫酸质量与放出氢气质量的差,因此,补绘的线段的终点高于原线段的沿长线.
解答:解:(1)该实验取用的样品质量=68.8g-51.8g=17g
故答案为:17g;
(2)根据质量守恒定律,恰好完全反应时放出氢气的质量=80g+68.8g-148.2g=0.6g,设参加反应铁的质量为x,则
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.6g
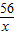 =
=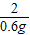 x=16.8g
x=16.8g样品中铁的质量分数=
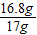 ×100%≈98.8%
×100%≈98.8%故答案为:98.8%;
(3)溶液中亚铁离子在溶液总质量中的质量分数=
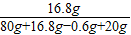 ×100%≈14.5%;
×100%≈14.5%;加入80g稀硫酸恰好完全反应前,溶液质量增加值为加入稀硫酸质量与放出氢气的质量差,而多加入的20g稀硫酸不再发生反应,溶液增加量即所加入稀硫酸的质量;由于多加入20g稀硫酸时溶液增加量大于恰好完全反应前的溶液增加量,所以,补绘此过程中稀硫酸的质量与烧杯及烧杯内物质的总质量的关系图,所得线段的终点位于线段AB延长线的上方;
故答案为:14.5%;上方.
点评:根据质量守恒定律,恰好完全反应时放出氢气的质量=恰好完全反应时所加稀硫酸的质量+实验开始时烧杯及烧杯内样品的质量-恰好完全反应时烧杯与烧杯内物质的质量.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
