题目内容
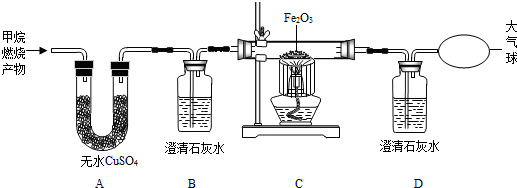
天然气的主要成分是甲烷(CH4),甲烷不仅是一种很好的燃料,而且是一种重要的化工原料.请你根据下列信息回答问题:
(1)甲烷在高温下可以分解为炭黑和氢气,炭黑可用来制造高级油墨.甲烷分解的化学方程式为:CH4
C+2H2,进行该反应必须使甲烷处于特别的环境中,你认为此处所指的特别环境是______.
(2)甲烷与氯气(C12)混合后在光照下可以发生下列反应:
CH4+Cl2
CH3Cl+HCl CH3C1+Cl2
CH2Cl2+HCl CH2Cl2+Cl2
CHCl3+HCl CHCl3+Cl2
CCl4+HCl
常温下,CH3Cl是气体,CH2Cl2、CHCl3、CCl4都是液体.CCl4可用于灭火,其原因是______(选填下列选项的序号).
A.CCl4是液体 B.CCl4含有Cl元素 C.CCl4中碳元素已经是最高的+4价,最稳定 D.CCl4的相对分子质量最大
(3)把CH3Cl缓慢通入被加热的烧碱溶液中,发生的反应为:CH3Cl+NaOH
CH3OH+NaCl+H2O.为了验证该反应的存在,某化学兴趣小组的同学做了下列实验:
①把一定量的CH3Cl缓慢通入被稀硝酸酸化的AgNO3溶液中,无白色沉淀产生,CH3C1全部从溶液中逸出.②把一定量CH3Cl缓慢通入被加热的烧碱溶液中,有少部分CH3Cl从溶液中逸出.一段时间后停止加热,待溶液温度降到接近室温后,取少量反应后的混合液于另一试管中,滴加稀硝酸至溶液呈酸性,再滴入AgNO3溶液,发现有白色沉淀产生.
该实验第①步的目的是______,该实验现象说明了什么?______.
实验②中,滴加稀硝酸至溶液呈酸性的原因是______.
(1)甲烷在高温下可以分解为炭黑和氢气,炭黑可用来制造高级油墨.甲烷分解的化学方程式为:CH4
| 高温 |
(2)甲烷与氯气(C12)混合后在光照下可以发生下列反应:
CH4+Cl2
| 光 |
| 光 |
| 光 |
| 光 |
常温下,CH3Cl是气体,CH2Cl2、CHCl3、CCl4都是液体.CCl4可用于灭火,其原因是______(选填下列选项的序号).
A.CCl4是液体 B.CCl4含有Cl元素 C.CCl4中碳元素已经是最高的+4价,最稳定 D.CCl4的相对分子质量最大
(3)把CH3Cl缓慢通入被加热的烧碱溶液中,发生的反应为:CH3Cl+NaOH
| H2O |
| △ |
①把一定量的CH3Cl缓慢通入被稀硝酸酸化的AgNO3溶液中,无白色沉淀产生,CH3C1全部从溶液中逸出.②把一定量CH3Cl缓慢通入被加热的烧碱溶液中,有少部分CH3Cl从溶液中逸出.一段时间后停止加热,待溶液温度降到接近室温后,取少量反应后的混合液于另一试管中,滴加稀硝酸至溶液呈酸性,再滴入AgNO3溶液,发现有白色沉淀产生.
该实验第①步的目的是______,该实验现象说明了什么?______.
实验②中,滴加稀硝酸至溶液呈酸性的原因是______.
(1)该反应是甲烷分解,如果不隔绝空气,甲烷会与氧气反应,所以特别环境是隔绝空气条件下的高温加热;
(2)CCl4可用于灭火必须是化学性质稳定,不以反应,覆盖在可燃物表面隔绝了空气;
(3)第①步的目的与实验②形成对比,根据CH3Cl缓慢通入被稀硝酸酸化的AgNO3溶液中,无白色沉淀产生,CH3Cl缓慢通入被加热的烧碱溶液中,能与硝酸银反应生成白色沉淀,说明CH3Cl不能提供产生AgCl白色沉淀的Cl--;滴加稀硝酸至溶液呈酸性的原因是先将过量的氢氧化钠反应掉,因为氢氧化钠能与硝酸银反应生成沉淀,避免对产生AgCl白色沉淀的干扰.
故答案为:
(1)隔绝空气条件下的高温加热;
(2)C;
(3)与实验②形成对比;说明CH3Cl不能提供产生AgCl白色沉淀的Cl--;中和反应后的混合液里过量的NaOH,避免对产生AgCl白色沉淀的干扰.
(2)CCl4可用于灭火必须是化学性质稳定,不以反应,覆盖在可燃物表面隔绝了空气;
(3)第①步的目的与实验②形成对比,根据CH3Cl缓慢通入被稀硝酸酸化的AgNO3溶液中,无白色沉淀产生,CH3Cl缓慢通入被加热的烧碱溶液中,能与硝酸银反应生成白色沉淀,说明CH3Cl不能提供产生AgCl白色沉淀的Cl--;滴加稀硝酸至溶液呈酸性的原因是先将过量的氢氧化钠反应掉,因为氢氧化钠能与硝酸银反应生成沉淀,避免对产生AgCl白色沉淀的干扰.
故答案为:
(1)隔绝空气条件下的高温加热;
(2)C;
(3)与实验②形成对比;说明CH3Cl不能提供产生AgCl白色沉淀的Cl--;中和反应后的混合液里过量的NaOH,避免对产生AgCl白色沉淀的干扰.

练习册系列答案
相关题目
 B.
B. C.
C.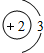 D.
D.