题目内容
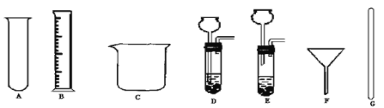
【题目】某中学化学兴趣小组利用下图所示装置测定样品中Fe2O3(样品中杂质高温下不分解,也不参加反应)的质量分数,请回答下列问题(化学方程式:3H2+Fe2O3高温2Fe+3H2O)

(1)实验开始时,应先挤压鼓气球持续一段时间,其目的是 。
(2)A装置的作用是 ;反应进行一段时间后C装置中的现象是 。
(3)反应前准确称量样品的质量为5g,完全反应后C装置增加了1.35g,则样品中Fe2O3的质量分数为 。
(4)若省去D装置,则实验所测定的样品中Fe2O3的质量分数比实际的质量分数会____________(填“偏大”“偏小”或“不变”)。
【答案】(1)将装置中的空气排干净,以免发生危险
(2)除去氢气中的水蒸气;白色固体逐渐变成蓝色(3)80%(4)偏大
【解析】
试题分析:实验开始时,应先挤压鼓气球持续一段时间,其目的是将装置中的空气排干净,以免发生危险,A装置的作用是利用浓硫酸的吸水性除去氢气中的水蒸气;反应进行一段时间后C装置中的现象是白色固体逐渐变成蓝色,从而检验水的产生,完全反应后C装置增加了1.35g ,设过程中氧化铁的质量为X,说明产生的水的质量为1.35克
3H2+Fe2O3![]() 2Fe+3H2O
2Fe+3H2O
160 54
X 1.35克
列比例式得160:X=54:1.35克 解得X=4克,则样品中Fe2O3的质量分数为=4克/5克×100%=80%,若省去D装置,则实验所测定的样品中Fe2O3的质量分数比实际的质量分数会大,因为外界的水会进入C装置。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目