题目内容
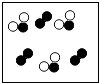
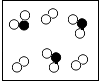
【题目】自来水消毒过程中常会发生如下化学反应,其反应的微观过程可用下图表示: 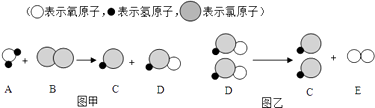
(1)图乙所示反应的基本反应类型为反应;
(2)写出E的化学式;
(3)D物质中中氢、氯、氧原子个数比是;
(4)ClO2读作 , ClO2是否是氧化物(填“是”或“不是”);
(5)ClO2中氯元素的化合价为价.
【答案】
(1)分解反应
(2)O2
(3)1:1:1
(4)二氧化氯;是
(5)+4
【解析】解:(1)图乙是2HClO=2HCl+O2 , 是一种物质生成两种物质的分解反应;(2)由E的微观构成可知,E化学式O2;(3)由D的微观构成可知,D物质中中氢、氯、氧原子个数比是1:1:1;(4)ClO2读作二氧化氯,ClO2是由绿和氧元素组成的化合物,属于氧化物;(5)ClO2中氯元素的化合价为+4.
故答为:(1)分解反应;(2)O2;(3)1:1:1;(4)二氧化氯,是;(5)+4.
【考点精析】关于本题考查的书写化学方程式、文字表达式、电离方程式和从组成上识别氧化物,需要了解注意:a、配平 b、条件 c、箭号;氧化物必须是由两种元素组成,而且是化合物.如:H2O、AI2O3、HCI 都是氧化物,它们也属于化合物,又是纯净物才能得出正确答案.

练习册系列答案
相关题目