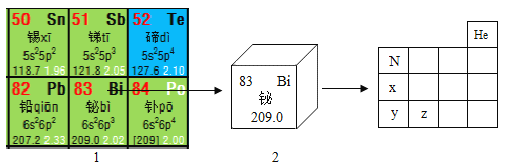
题目内容
【题目】同学们发现铜生锈后变成绿色物质,请教老师后得知其主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO2,并在老师建议下完成了下列实验:

(提出问题)碱式碳酸铜受热后生成的黑色固体是什么?
(猜想与假设)小花同学提出如下三种猜想:
猜想一:黑色固体是炭粉;
猜想二:黑色固体是氧化铜;
猜想三:黑色固体是二氧化锰。
你认为猜想_____不正确,理由是_____。
(进行实验)小花同学查阅资料后得知:炭粉不与稀盐酸反应,而氧化铜能与稀盐酸反应,于是又进行了下列实验。
取少量黑色固体于试管中,加入足量稀盐酸,加热,观察到黑色固体全部溶解,说明猜想_____成立。
(得出结论)碱式碳酸铜分解后生成了氧化铜和水。但小美同学仔细分析数据后发现应该还有其他物质。你认为她的依据是_____。
(讨论与反思)其他物质最有可能是二氧化碳,请你设计实验证明该物质的存在:_____。据此,请写出碱式碳酸铜受热分解的化学方程式:_____。
【答案】三 碱式碳酸铜中不含锰元素(合理即可) 二 生成的两种物质的总质量小于碱式碳酸铜的质量,若没有其他物质生成不符合质量守恒定律(合理即可) 另取一定量碱式碳酸铜于试管中加热,将产生的气体通入澄清石灰中,观察到澄清石灰水变浑浊 Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
【解析】
猜想三不正确,理由是根据质量守恒定律,反应前后元素种类不变,碱式碳酸铜中不含锰元素,不可能生成二氧化锰;
进行实验:
取少量黑色固体于试管中,加入足量稀盐酸,加热,观察到黑色固体全部溶解,说明猜想二成立。因为碳单质和稀盐酸不反应,氧化铜和稀盐酸反应生成氯化铜、水,黑色固体溶解。
得出结论:
碱式碳酸铜分解后生成了氧化铜和水。但小美同学仔细分析数据后发现应该还有其他物质。你认为她的依据是生成的两种物质的总质量小于碱式碳酸铜的质量,若没有其他物质生成不符合质量守恒定律(合理即可)。
讨论与反思:
其他物质最有可能是二氧化碳,二氧化碳能使澄清石灰水验证,设计实验证明该物质的存在:另取一定量碱式碳酸铜于试管中加热,将产生的气体通入澄清石灰中,观察到澄清石灰水变浑浊,碱式碳酸铜受热分解的化学方程式:Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑。
2CuO+H2O+CO2↑。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】二氧化碳是自然界中一种重要的资源。
一、二氧化碳的用途
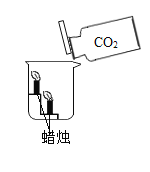
(1)下图实验,观察到的现象是________,说明二氧化碳可用于________。
(2)自然界中,二氧化碳可通过________作用,产生氧气。
(3)将二氧化碳加压、降温制成固态二氧化碳,俗称______,可用于人工降雨、舞台云雾等。
二、二氧化碳的制取
(1)实验室可用下图装置A制CO2,a中加入的物质是_____。反应的符号表达式是______。
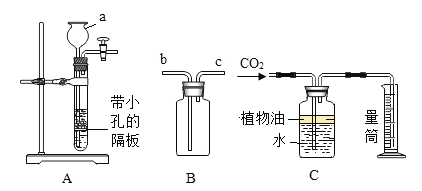
(2)装置B和C均可以收集CO2,若用B收集则气体应从_____端(选填“b”或“c”)通入。若用C装置收集,植物油的作用是_____。
三、二氧化碳的测定
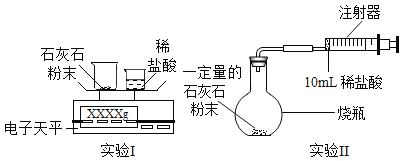
测定石灰石(主要成分为碳酸钙,其他物质不与酸反应)与稀盐酸(实验中酸均足量)反应生成CO2的质量和体积,并处理数据。
(实验设计)通过下列两个实验分别测定CO2的质量和体积,并处理数据。
(分析与思考)
(1)实验1时,将小烧杯中稀盐酸分几次加入到大烧杯中,并不断搅拌,判断石灰石中碳酸钙完全反应的操作及实验现象是:最后一次加入稀盐酸,________。
(2)实验2时,先连接装置,再_______(填操作名称),然后装好药品,最后将10ml稀盐酸快速推入烧瓶中。
(记录与处理)
(1)实验1中电子天平的精确度较高,已知:反应前的总质量(m(大烧杯+石灰石粉末)+m(小烧杯+稀盐酸)),要计算生成CO2的质量,至少还需要的数据是_______。(填字母)
A m(小烧杯) B m(大烧杯) C m(大烧杯+反应后剩余物)
(2)实验2的实验记录如下(表中数据在相同温度、相同压强条件下测定)
时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
注射器读数/ml | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
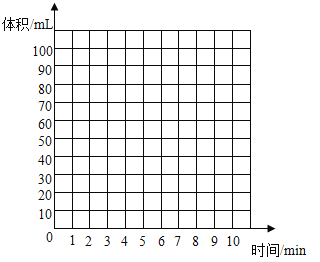
①综合分析,最终生成CO2的体积是________ml。
②在坐标图中用曲线绘制出0-10min生成CO2体积随时间变化的曲线._______
(反思与评价)请你综合各方面原因分析
(1)实验1操作简单,便于读数,但最终CO2质量的测量值比理论值偏大,可能的原因是_____。
(2)实验Ⅱ的优点是_______。
【题目】化学中有很多“不一定”,下列所举例证错误的是
选项 | 化学中的“不一定” | 所举例证 |
A | 一种元素不一定只能组成一种物质 | 碳元素可以组成金刚石和石墨 |
B | 同种物质燃烧时现象不一定相同 | 硫在空气中燃烧产生淡蓝色火焰,在氧气中燃烧产生明亮的蓝紫色火焰 |
C | 同种元素在同一物质中不一定只显示一种化合价 | 氮元素在NH4NO3中显-3价和+5价 |
D | 高温条件下碳不一定只能跟金属氧化物反应 | 3C+2Fe2O3 |
A.AB.BC.CD.D
【题目】渤海湾丰富的自然资源为我们的日常生产和生活提供了很大的便利。
(1)海水属于____(填“纯净物”或“混合物”);海水晒盐属于混合物分离操作中的___。(填序号)
A 蒸馏 B 蒸发 C 过滤 D 沉淀
(2)渤海油气资源丰富,石油加工可得到石油液化气,假设某石油液化气的主要成分为C4H10,写出其完全燃烧的化学方程式______;小明家欲将石油液气灶改为天然气(主要成分CH4)灶具,他应将空气管口_______(填“增大”或“减小”)。
(3)生铁和钢是世界上用量最大的________(填“金属材料”或“合成材料”);炼铁的原理是利用一氧化碳与氧化铁反应,反应的化学方程式为________
(4)渤海湾盛产食盐,下表是NaCl、NH4Cl在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/ g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | |
①以上两种物质溶解度的变化受温度影响较小的是________。
②20℃时,将40gNaCl加入到100g水中充分搅拌后,所得溶液的质量为________g。
③40℃时,要使接近饱和的NH4Cl溶液变为饱和溶液,下列方法中一定能达到目的的是________(填序号)。
A 升高温度 B 加溶质NH4Cl C 加水 D 恒温蒸发水
(5)当地人从渤海湾引水浇灌当地的大樱桃和白黄瓜,这些瓜果含的营养元素主要有哪些(水除外)_______;为提高这些瓜果的产量,他们采用了滴灌梯度施肥技术,在幼苗期以_________肥为主,促进根系发达.
【题目】把一定质量的甲、乙、丙三种物质放入一密闭容器中完全反应,实验测得反应前后数据如下表.则下列说法中正确的是()
甲 | 乙 | 丙 | 丁 | |
反应前质量(g) | 23 | 60 | 5 | 0 |
反应后质量(g) | 23 | 20 | x | 25 |
A.x= 20
B.该反应中甲一定是催化剂
C.反应后,密闭容器中还有三种物质
D.参加反应的乙、丁质量比为40:15