题目内容
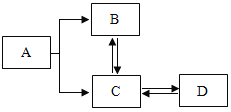
【题目】为了除去KCl溶液中的少量MgCl2和MgSO4,从Na2SO3溶液、HCl(稀)、Ba(NO3)2溶液、K2CO3溶液、Ba(OH)2溶液中选择A、B、C 三种试剂,按以下步骤实验:
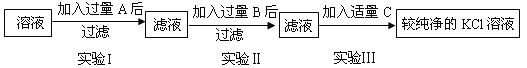
(1)A、B、C三种试剂中的溶质的化学式是A______、B______、C______.
(2)在实验1中,所加的 A 溶液应该过量,目的是______.
(3)实验Ⅱ中有关化学方程式是______.
(4)实验Ⅲ中,要得到较为纯净的KCl溶液,所加试剂C应当适量.在此实验中,当试剂加到______的时候,就应停止再加.
【答案】Ba(OH)2 K2CO3 HCl 完全除去MgCl2和 MgSO4 Ba(OH)2+K2CO3═BaCO3↓+2KOH 不再产生气泡为止
【解析】
(1)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,可加入Ba(OH)2溶液,MgCl2和 MgSO4均能与氢氧化钡溶液反应,生成氢氧化镁沉淀和硫酸钡沉淀,过滤后,再加入过量的碳酸钾溶液,碳酸钾能与氢氧化钡溶液反应生成碳酸钡沉淀和氢氧化钾,再加入适量的稀盐酸,氢氧化钾与稀盐酸反应生成氯化钾和水,能除去杂质且没有引入新的杂质,符合除杂原则,故A、B、C的化学式分别是Ba(OH)2、K2CO3、HCl。
(2)在实验1 中,所加的 A (氢氧化钡)溶液应该过量,目的是完全除去MgCl2和 MgSO4。
(3)实验Ⅱ碳酸钾与氢氧化钡溶液反应生成碳酸钡沉淀和氢氧化钾,反应的化学方程式为:Ba(OH)2+K2CO3═BaCO3↓+2KOH。
(4)实验Ⅲ中,加入加试剂C(稀盐酸)是为了除去滤液中的氢氧化钾和碳酸钾,盐酸先和氢氧化钾反应生成氯化钾和水,无明显现象;待氢氧化钾反应完后,盐酸和碳酸钾反应生成氯化钾、水和二氧化碳,会产生气泡,当恰好不再产生气泡时,说明溶液中的碳酸钾恰好反应完,就可以停止加稀盐酸;故在此实验中,当试剂加至不再产生气泡为止,就应停止再加。