题目内容
分析和推理是学习和研究化学的重要方法。下列说法不正确的是( )
A.氧化物一定含有氧元素,含有氧元素的化合物不一定是氧化物
B.同种元素原子的质子数相同,则质子数相同的原子一定是同种元素
C.有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物
D.盐是由金属离子和酸根离子构成的,NH4NO3中没有金属离子,不属于盐
 阅读快车系列答案
阅读快车系列答案2018年10月3日,搜狐网报道,中国居然用铝合金造军舰,外形十分科幻和美军的几乎一模一样。为测定建造军舰的材料某铝合金中铝的质量分数,兴趣小组同学称取该样品20g铝合金粉末于烧杯中,将400g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:(假设该铝合金中只有铝能与稀硫酸反应,其他成分不与稀硫酸反应)
实验 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀硫酸的质量(g) | 100 | 100 | 100 | 100 |
烧杯中剩余物的质量(g) | 119.2 | 218.4 | 318.0 | m |
(1)实验中m的数值_____。
(2)该铝合金样品中铝的质量分数为_____?(写出计算过程)
(3)第三次加入稀硫酸后,溶液的成分是_______。
NaOH在工业上具有广泛的应用,某研究性学习小组通过以下实验探究NaOH的性质。
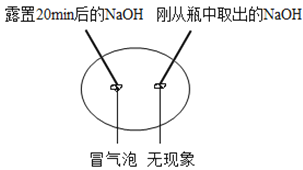
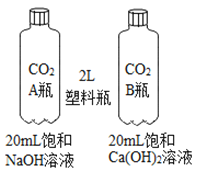
实验一 向两块固体表面滴加稀盐酸 | 实验二 振荡2个塑料瓶 |
|
|
(1)实验一中滴加盐酸后产生的气泡的化学式为_______________。
(2)实验二中振荡2个塑料瓶,观察到塑料瓶变瘪的程度为A>B, A瓶出现沉淀,B瓶中先有白色沉淀,继续振荡后沉淀消失。
①请说出一-种鉴别NaOH固体和Ca(OH)2固体的物理方法:__________________。
②B瓶中产生沉淀的化学方程式为_________________。
(3)在20°C时,研究小组对A瓶中产生沉淀的原因及成分做了如下探究:
[提出问题]两只塑料瓶中发生了哪些反应,得到了哪些物质?
[查阅资料]①20°C时,有关物质的溶解度如下表所示:
物质 | NaOH | Ca(OH)2 | Na2CO3 | NaHCO3 | CaCO3 | Ca(HCO3)2 |
溶解度/g | 109 | 0.18 | 21.5 | 9.6 |
| 16.6 |
②CO2可以与Na2CO3溶液发生反应: 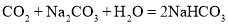 。
。
③NaHCO3固体在120°C开始分解:  。Na2CO3 加热不分解。
。Na2CO3 加热不分解。
④常温下,饱和Na2CO3溶液pH为12.3, 饱和NaHCO3溶液pH为8.1。
根据以上资料和实验现象推断:B瓶最终所得澄清溶液中所含溶质为____________。
[提出猜想]对A瓶中沉淀成分有以下四种猜想:猜想Ⅰ : NaOH和Na2CO3;
猜想Ⅱ: Na2CO3; 猜想Ⅲ: Na2CO3 和NaHCO3; 猜想Ⅳ: NaHCO3。
小组同学经过讨论分析后,认为“猜想I”不成立,其理由是___________________。
[实验探究]将A瓶固体过滤后,用冰水洗涤,在烘箱中烘干。烘箱温度应控制为_______________。
小组甲:取2g固体溶于98gH2O配成溶液,用pH试纸测得其pH约为11。则_______________(填“猜想Ⅱ”、“猜想Ⅲ”、“猜想Ⅳ”)不成立。.
小组乙:取干燥固体在硬质大试管中加热,并将导管通入装有澄清石灰水的烧杯中。加热过程中,一直未见烧杯中有沉淀产生;将试管中固体冷却后称量, 其质量__________(填“变大”“变小”或“不变”)。
[实验结论]____________(填“猜想Ⅱ”、“猜想Ⅲ”、“猜想Ⅳ”)是正确的。
[反思评价]若不进行实验操作,仅通过比较塑料瓶中气体和溶液中溶质质量的相对关系,也可推断出A瓶中所得产物种类,还需要查阅或测量的数据是_______________。
小英同学为了测定某地区石灰石样品中碳酸钙的质量分数,取该样品15g,现将75mL的稀盐酸分三次加入石灰石样品中,每次充分反应后测得生成气体的质量,实验数据如下表:
实验 | 第一次 | 第二次 | 第三次 |
加入稀盐酸的量/mL | 25 | 25 | 25 |
生成气体的质量/g | 2.2 | m | 1.1 |
试求:
(1)m的值是_____g.
(2)求该样品中碳酸钙的质量分数(保留一位小数).______


 2H2O
2H2O 2Fe+3CO2
2Fe+3CO2
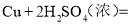 _____________
_____________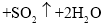
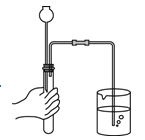 检查气密性 B.
检查气密性 B. 熄灭酒精灯 C.
熄灭酒精灯 C.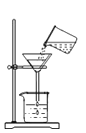 过滤悬浊液 D.
过滤悬浊液 D.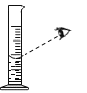 读液体体积
读液体体积