题目内容
将10克KClO3和MnO2的混合物放在试管里加热,反应了一段时间后停止加热,冷却后,称得反应后的固体物质,结果MnO2的质量分数由反应前的25%变为反应后的30%,计算该反应中KClO3的分解质量分数是多少?
解:10克KClO3和MnO2的混合物中MnO2的质量分数为25%,所以MnO2的质量为2.5g,KClO3的质量是7.5g。
设KClO3分解放出O2质量为x,则反应后余下质量为10-x,这包括MnO2,生成的KCl及未分解的KClO3,其中MnO2占30%,则
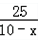 ×100%=30%,解得x=1.67g
×100%=30%,解得x=1.67g
设生成1.67克O2分解KClO3质量为y.
2KClO3 2KCl+3O2↑
2KCl+3O2↑
245 96
y 1.67g
 ,解得:y=4.3克,
,解得:y=4.3克,
所以KClO3分解率= ×100%=57%
×100%=57%
答:反应中KClO3的分解质量分数为75%。
设KClO3分解放出O2质量为x,则反应后余下质量为10-x,这包括MnO2,生成的KCl及未分解的KClO3,其中MnO2占30%,则
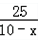 ×100%=30%,解得x=1.67g
×100%=30%,解得x=1.67g设生成1.67克O2分解KClO3质量为y.
2KClO3
 2KCl+3O2↑
2KCl+3O2↑245 96
y 1.67g
 ,解得:y=4.3克,
,解得:y=4.3克,所以KClO3分解率=
 ×100%=57%
×100%=57%答:反应中KClO3的分解质量分数为75%。

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案
相关题目