题目内容
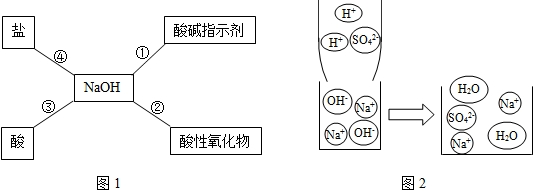
(14分)归纳总结是学习化学的重要方法,小明同学用图l总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)。
(1)为了验证反应①,小明将无色酚酞试液滴入NaOH液中,溶液变成 色。
(2)依据反应②说明NaOH必须密封保存,否则在空气中要变质,其化学反应方程式为:
(3)小明用微观示意图(图2)来说明反应③的发生,用化学反应方程式表示为: ,反应类型为 ;从该图可以看出,反应前后没有发生变化的微观粒子有 和 。在图2所示的反应过程中,小明对反应溶液的pH进行了三次测定,当溶液pH=10时,溶液中溶质为 (填化学式,下同);pH=7时,溶质为 ;pH=3时,溶质为 。
(4)为了验证反应④能够发生,你选择的物质是 ,其化学反应方程式为
。
⑴红 (2)2NaOH+CO2=Na2CO3+H2O
(3)2NaOH + H2SO4== Na2SO4+H2O 复分解(中和)反应 Na+ SO42—
Na2SO4 NaOH ;Na2SO4 ;Na2SO4 H2SO4
(4)CuSO4 2NaOH + CuSO4="=" Cu(OH)2↓+ Na2SO4 (其他答案合理给分)
解析试题分析:(1)无色酚酞遇碱变红色,故填:红;
(2)氢氧化钠能与空气二氧化碳反应生成二氧化碳和水,而变质,故应密封保存,化学方程式为:2NaOH+CO2=Na2CO3+H2O;
(3)由图2可知,容器中是氢氧根离子和钠离子,加入的是硫酸根离子和氢离子,所以反应物是氢氧化钠和硫酸,生成物中有钠离子、硫酸根离子和水分子,所以生成物是硫酸钠和水,其化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O;由图可知,反应前后钠离子、硫酸根离子没有发生变化;当溶液PH=10时,溶液呈碱性,溶液应为NaOH溶液;当溶液PH=7时,溶液呈中性,溶液应为NaCl;当溶液PH=3时,溶液呈酸性,溶液应为H2SO4;
(4)反应④是盐和氢氧化钠反应,属于复分解反应,硫酸铜和氢氧化钠反应生成硫酸铜沉淀和硫酸钠,满足复分解反应的条件,符合要求,其化学方程式为2NaOH + CuSO4="=" Cu(OH)2↓+ Na2SO4。
考点:酸、碱、盐的鉴别;碱的化学性质。
点评:在解此类题时,首先分析图示所表示的反应的实质,然后结合学过的知识和复分解反应的条件进行解答。

| 序号 | 错误结论 | 否定实例 | ||||
| 例: | 燃烧一定有氧气参加 | 2Mg+CO2
| ||||
| ① | 常温下金属都是固体 | |||||
| ② | 物质的溶解度都随温度的升高而增大 | |||||
| ③ | 能生成CO2的反应都可用于实验室制取CO2 |


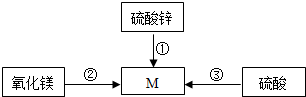 归纳总结是学习化学的重要方法,如图是某同学对有关知识的总结,请依据下列几种化合物能通过一步反应转化为含镁化合物M的转化关系填写空格:如图中物质M属于
归纳总结是学习化学的重要方法,如图是某同学对有关知识的总结,请依据下列几种化合物能通过一步反应转化为含镁化合物M的转化关系填写空格:如图中物质M属于